Spatiotemporally controlado translocación Nuclear de los huéspedes en las células vivas utilizando colas Molecular enjaulados como etiquetas de Photoactivatable
Summary
Este protocolo describe translocación nuclear activada por luz de huéspedes en las células vivas utilizando etiquetas enjaulado pegamento molecular. Este método es prometedor para la entrega de drogas dirigidas a nuclear sitio selectivo.
Abstract
El núcleo es uno de los orgánulos más importantes como objetivo subcelular-administración de fármacos, desde la modulación de la replicación de genes y expresión es eficaz para tratar diversas enfermedades. Aquí, demostramos enjaulado de translocación nuclear activada por la luz de los huéspedes que utilicen etiquetas pegamento molecular (enjauladopegamento-R), cuyos múltiples colgantes de ion (Gu+) Guanidinio están protegidos por un grupo de photocleavable aniónico (butirato-sustituido nitroveratryloxycarbonyl; BA NVOC). Los huéspedes etiquetados Cagedpegamento-R se toman en la vida las células mediante endocitosis y permanecer en endosomas. Sin embargo, en photoirradiation, Cagedpegamento-R se convierte en uncaged molecular pegamento (pegamento deUncaged-R) llevar varios colgantes de Gu+ , que facilita el escape endosomal y la subsecuente translocación nuclear de los invitados. Este método es prometedor para selectivo sitio nuclear contra entrega de la droga, ya que los invitados etiquetados pueden migrar en el citoplasma, seguido por el núcleo celular sólo cuando photoirradiated. Enjaulado Etiquetas cola-R pueden ofrecer a invitados macromoleculares como puntos cuánticos (QDs) así como huéspedes de moléculas pequeñas. Enjaulado Etiquetas cola-R pueden ser uncaged con luz UV, pero también dos fotones (NIR) la luz infrarroja, que puede penetrar profundamente en el tejido.
Introduction
El núcleo de la célula, que lleva la información genética, es uno de los orgánulos más importantes como objetivo subcelular-administración de fármacos, desde la modulación de la replicación de genes y expresión es eficaz para el tratamiento de varias enfermedades incluyendo el cáncer y genética trastornos1,2,3. Para nuclear entrega de medicamentos, Conjugación de péptidos etiquetas tales como localización nuclear (NLS) de señales4,5,6 ha sido ampliamente investigada. Sin embargo, para reducir efectos colaterales no deseados, es necesario el control espacio-temporal de la translocación nuclear.
Previamente, activadas por luz desplazamiento de proteínas en el núcleo celular se ha logrado utilizando jaulas NLS7,8,9. NLS emigra en el núcleo de la célula atando a transporte citoplásmico proteínas6. En los métodos divulgados, proteínas huésped teniendo enjaulados NLS directamente incorporadas en el citoplasma por microinyección8 o expresadas en las células diana mediante un código genético expansión técnica9. Por lo tanto, un método que puede lograr la absorción celular y translocación nuclear foto-inducida es ventajoso para aplicaciones prácticas.
Adjunto, describimos desplazamiento nuclear activada por la luz de los huéspedes en las células vivas utilizando etiquetas dendríticas pegamento molecular enjaulado (Cagedpegamento-R, figura 1). Pega molecular solubles en agua10,11,12,13,14,15,16,17,18 , 19 , 20 , 21 , 22 , 23 cojinete varios colgantes de Gu+ se han desarrollado anteriormente que se adhieren firmemente a proteínas11,12,13,14,15, 16,17, los ácidos nucleic18,19,20, fosfolípido de las membranas21y arcilla nanosheets22,23 a través de la formación de múltiples puentes de sal entre sus colgantes de Gu+ y grupos oxyanionic en los objetivos. Los colgantes de Gu+ de Cagedpegamento-R están protegidos por un grupo de photocleavable aniónico, nitroveratryloxycarbonyl butirato-sustituido (BANVOC). Los huéspedes etiquetados Cagedpegamento-R se toman en la vida de las células mediante endocitosis y estancia en endosomas (figura 2). En photoirradiation, los grupos NVOC BAde Cagedpegamento-R son despegados para rendir un uncaged molecular pegamento (pegamento deUncaged-R) llevar varios colgantes de Gu+ , que luego facilita la migración de la huésped de etiquetado en el citoplasma, seguido por el núcleo de la célula (figura 2). La etiqueta de Cagedpegamento-R puede ser uncaged por la exposición a UV o dos fotones la luz de infrarrojo cercano (NIR) sin fototoxicidad grave. Demostramos la entrega nuclear spatiotemporally controlada de huéspedes macromoleculares como los huéspedes de molécula pequeña con las etiquetas de cola-R Caged, usando puntos cuánticos (QDs) y un colorante fluorescente (nitrobenzoxadiazole; Al siguiente día laborable), respectivamente, como ejemplos.
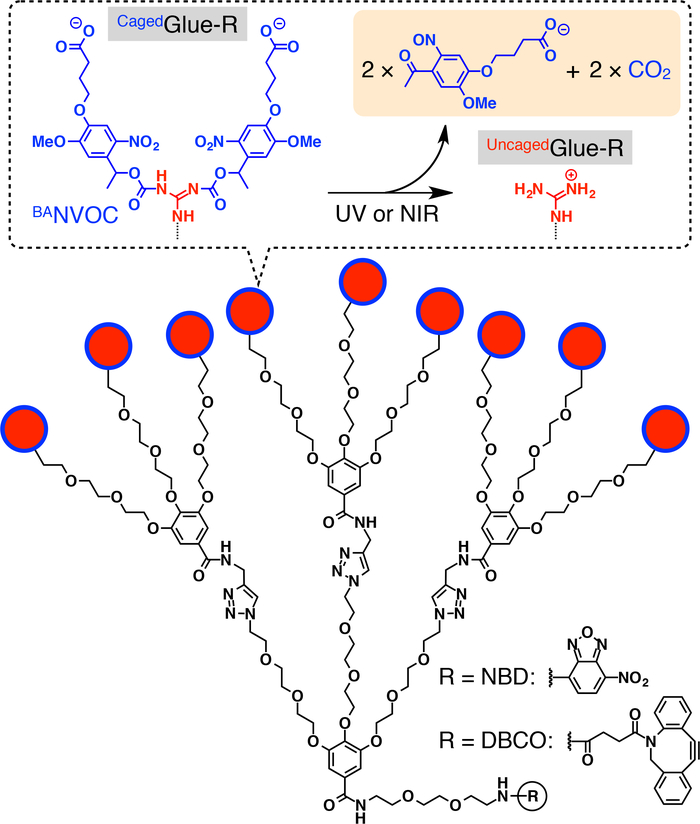
Figura 1: Estructuras esquemáticas del Cagedpegamento-R. Los colgantes de ion (Gu+) Guanidinio 9 de Cagedpegamento-R están protegidos por un grupo de nitroveratryloxycarbonyl butirato-sustituido (BANVOC). Los grupos NVOC BAson troceados por la irradiación con UV o luz NIR dos fotones. El núcleo focal de Cagedpegamento-R es functionalized con nitrobenzoxadiazole (NBD) o dibenzocylooctyne (DBCO). Reimpreso con el permiso de referencia20. Haga clic aquí para ver una versión más grande de esta figura.
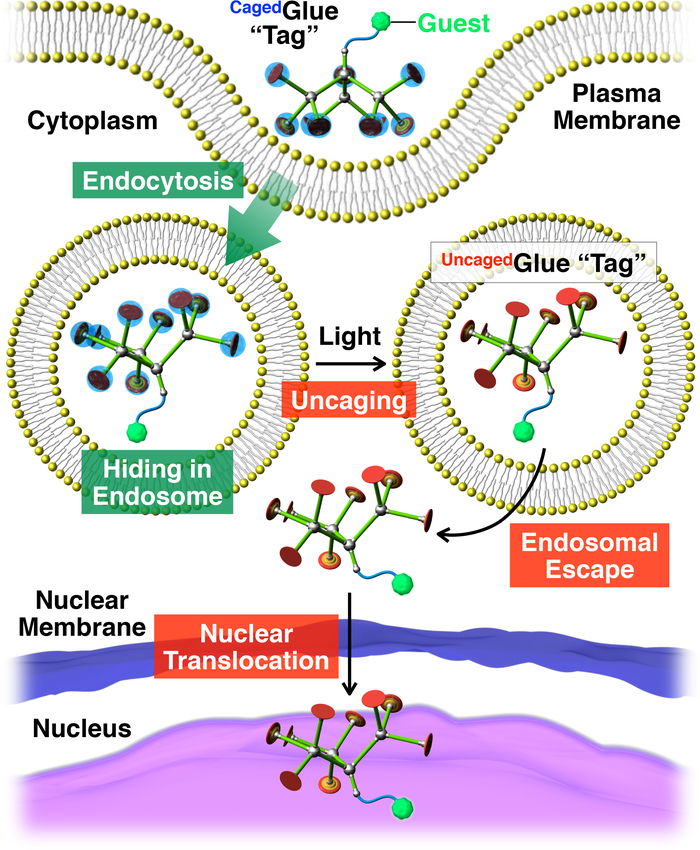
Figura 2: Ilustración esquemática de translocación nuclear activada por la luz de los huéspedes conjugado con una etiqueta de Cagedpegamento-R. El invitado /Cagedconjugado de pegamento-R es tomado en la vida de las células mediante endocitosis. En photoirradiation, el Cagedpegamento-R es uncaged para obtener una etiqueta de pegamento-R Uncaged, que puede facilitar el escape endosomal de la huésped de etiquetado. Posteriormente, el huésped etiquetado emigra en el núcleo celular. Reimpreso con el permiso de referencia20. Haga clic aquí para ver una versión más grande de esta figura.
Protocol
Representative Results
Discussion
Investigaciones anteriores de activadas por luz desplazamiento de proteínas en el núcleo celular se han logrado utilizando jaulas NLS7,8,9. Como se mencionó anteriormente, estos métodos requieren técnicas adicionales para incorporar las proteínas etiquetadas de NLS en el citoplasma. En cambio, nuestra etiqueta de pegamento-R Cagedpermite la translocación nuclear foto-inducida, sino también la absorción celula…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Reconocemos el centro para la integración de NanoBio, la Universidad de Tokio. Este trabajo fue apoyado por subvenciones para jóvenes científicos (B) (26810046) K.O. y parcialmente financiado por subvenciones de investigación promovido especialmente (25000005) a T.A. R.M. gracias la becas de investigación de la sociedad de Japón para la promoción de la ciencia (JSPS ) para jóvenes científicos y el programa de líderes en las escuelas de posgrado (GPLLI).
Materials
| Azide-PEG4-NHS ester | Click Chemistry Tools | AZ103 | |
| Q-dot 655 ITK | Invitrogen | Q21521MP | |
| Regenerated cellulose membrane (MWCO 3,500) | NIPPON Genetics | TOR-3K | |
| Regenerated cellulose membrane (MWCO 25,000) | Harvard Apparatus | 7425-RC25K | |
| Hep3B Cells | ATCC | HB-8064 | |
| 8-chambered glass substrate | Nunc | 155411JP | |
| 96-well culture plate | Nunc | 167008 | |
| Eagle's minimal essential medium (EMEM) | Thermo Fisher Scientific | 10370-021 | |
| Fetal bovine serum (FBS) | GE Healthcare | SH30406.02 | |
| Dulbecco's phosphate buffer saline (D-PBS) | Wako Pure Chemical Industries | 045-29795 | |
| LysoTracker Red | Lonza Walkersville | PA-3015 | |
| Hoechst 33342 | Dojindo | H342 | |
| Cell Counting Kit-8 | Dojindo | CK04 | |
| Confocal laser scanning microscope | Carl-Zeiss | LSM 510 | Equipped with two-photon excitation laser (Mai Tai laser, Spectra-Physics) |
| Confocal laser scanning microscope | Leica | TCS SP8 | |
| Xenon light source | Asahi Spectra | LAX-102 | |
| Microplate reader | Molecular Devices | SpectraMax Paradigm |
References
- Miller, A. D. Human gene therapy comes of age. Nature. 357, 455-460 (1992).
- Roth, J. A., Cristiano, R. J. Gene Therapy for Cancer: What Have We Done and Where Are We Going. Journal of the National Cancer Institute. 89, 21-39 (1997).
- Verma, I. M., Weitzman, M. D. GENE THERAPY: Twenty-First Century Medicine. Annual Review of Biochemistry. 74, 711-738 (2005).
- Ragin, A. D., Morgan, R. A., Chmielewski, J. Cellular Import Mediated by Nuclear Localization Signal Peptide Sequences. Chemistry & Biology. 9, 943-948 (2002).
- Martin, R. M., et al. Principles of protein targeting to the nucleolus. Nucleus. 6, 314-325 (2015).
- Sun, Y., et al. Factors influencing the nuclear targeting ability of nuclear localization signals. Journal of Drug Targeting. 24, 927-933 (2016).
- Ventura, B. D., Kuhlman, B. Go in! Go out! Inducible control of nuclear localization. Current Opinion in Chemical Biology. 34, 62-71 (2016).
- Watai, Y., Sase, I., Shiono, H., Nakano, Y. Regulation of nuclear import by light-induced activation of caged nuclear localization signal in living cells. FEBS Letters. 488, 39-44 (2001).
- Engelke, H., Chou, C., Uprety, R., Jess, P., Deiters, A. Control of Protein Function through Optochemical Translocation. ACS Synthetic Biology. 3, 731-736 (2014).
- Mogaki, R., Hashim, P. K., Okuro, K., Aida, T. Guanidinium-based "molecular glues" for modulation of biomolecular functions. Chemical Society Reviews. 46, 6480-6491 (2017).
- Okuro, K., Kinbara, K., Tsumoto, K., Ishii, N., Aida, T. Molecular Glues Carrying Multiple Guanidinium Ion Pendants via an Oligoether Spacer: Stabilization of Microtubules against Depolymerization. Journal of the American Chemical Society. 131, 1626-1627 (2009).
- Okuro, K., et al. Adhesion Effects of a Guanidinium Ion Appended Dendritic "Molecular Glue" on the ATP-Driven Sliding Motion of Actomyosin. Angewandte Chemie, International Edition. 48, 3030-3033 (2010).
- Uchida, N., et al. Photoclickable Dendritic Molecular Glue: Noncovalent-to-Covalent Photochemical Transformation of Protein Hybrids. Journal of the American Chemical Society. 135, 4684-4687 (2013).
- Garzoni, M., Okuro, K., Ishii, N., Aida, T., Pavan, G. M. Structure and Shape Effects of Molecular Glue on Supramolecular Tubulin Assemblies. ACS Nano. 8, 904-914 (2014).
- Mogaki, R., Okuro, K., Aida, T. Molecular glues for manipulating enzymes: trypsin inhibition by benzamidine-conjugated molecular glues. Chemical Science. 6, 2802-2805 (2015).
- Okuro, K., Sasaki, M., Aida, T. Boronic Acid-Appended Molecular Glues for ATP-Responsive Activity Modulation of Enzymes. Journal of the American Chemical Society. 138, 5527-5530 (2016).
- Mogaki, R., Okuro, K., Aida, T. Adhesive Photoswitch: Selective Photochemical Modulation of Enzymes under Physiological Conditions. Journal of the American Chemical Society. 139, 10072-10078 (2017).
- Hashim, P. K., Okuro, K., Sasaki, S., Hoashi, Y., Aida, T. Reductively Cleavable Nanocaplets for siRNA Delivery by Template-Assisted Oxidative Polymerization. Journal of the American Chemical Society. 137, 15608-15611 (2015).
- Hatano, J., Okuro, K., Aida, T. Photoinduced Bioorthogonal 1,3-Dipolar Poly-cycloaddition Promoted by Oxyanionic Substrates for Spatiotemporal Operation of Molecular Glues. Angewandte Chemie, International Edition. 55, 193-198 (2016).
- Arisaka, A., Mogaki, R., Okuro, K., Aida, T. Caged Molecular Glues as Photoactivatable Tags for Nuclear Translocation of Guests in Living Cells. Journal of the American Chemical Society. 140, 2687-2692 (2018).
- Suzuki, Y., Okuro, K., Takeuchi, T., Aida, T. Friction-Mediated Dynamic Disordering of Phospholipid Membrane by Mechanical Motions of Photoresponsive Molecular Glue: Activation of Ion Permeation. Journal of the American Chemical Society. 134, 15273-15276 (2012).
- Wang, Q., et al. High-water-content mouldable hydrogels by mixing clay and a dendritic molecular binder. Nature. 463, 339-343 (2010).
- Tamesue, S., et al. Linear versus Dendritic Molecular Binders for Hydrogel Network Formation with Clay Nanosheets: Studies with ABA Triblock Copolyethers Carrying Guanidinium Ion Pendants. Journal of the American Chemical Society. 135, 15650-15655 (2013).
- Mohr, D., Frey, S., Fischer, T., Güttler, T., Görlich, D. Characterisation of the passive permeability barrier of nuclear pore complexes. EMBO Journal. 28, 2541-2553 (2009).
- Best, M. D. Click Chemistry and Bioorthogonal Reactions: Unprecedented Selectivity in the Labeling of Biological Molecules. Biochemistry. 48, 6571-6584 (2009).
- Klán, P., et al. Photoremovable Protecting Groups in Chemistry and Biology: Reaction Mechanisms and Efficacy. Chemical Reviews. 113, 119-191 (2013).

