Spatiotemporally controllato traslocazione nucleare di ospiti in cellule viventi utilizzando colle molecolare in gabbia come tag fuse
Summary
Questo protocollo descrive la traslocazione nucleare attivato luce di ospiti in cellule viventi utilizzando tag colla molecolare in gabbia. Questo metodo è promettente per il nucleare-targeting selettivo sito drug delivery.
Abstract
Il nucleo cellulare è uno degli organelli più importanti come obiettivo subcellulare della droga consegna, dalla modulazione della replica di gene ed espressione è efficace per il trattamento di varie malattie. Qui, dimostriamo che la traslocazione nucleare attivato luce degli ospiti usando in gabbia Tag colla molecolare (Cagedcolla-R), cui più pendenti di guanidinium ione (Gu+) sono protetti da un gruppo di photocleavable anionici (butirrato-sostituiti nitroveratryloxycarbonyl; BA NVOC). Gli ospiti con etichettati Cagedcolla-R sono presi in vita le cellule tramite endocitosi e rimangono in endosomi. Tuttavia, al momento photoirradiation, Cagedcolla-R è convertito in uncaged molecolare colla (Uncagedcolla-R) che trasportano più pendenti Gu+ , che facilita la fuga endosomal e conseguente traslocazione nucleare degli ospiti. Questo metodo è promettente per il nucleare-targeting selettivo sito drug delivery, poiché gli ospiti con tag possono migrare nel citoplasma seguito da nucleo cellulare solo quando photoirradiated. In gabbia Tag: colla-R in grado di fornire macromolecolari ospiti come punti quantici (QD) così come gli ospiti della piccolo-molecola. In gabbia Tag: colla-R può essere uncaged con non solo luce UV, ma anche luce di due fotoni vicino infrarosso (NIR), che possa penetrare in profondità nel tessuto.
Introduction
Il nucleo delle cellule, che porta le informazioni genetiche, è uno degli organelli più importanti come obiettivo subcellulare della droga consegna, dalla modulazione della replica di gene ed espressione è efficace per il trattamento di varie malattie tra cui il cancro e genetica disordini di1,2,3. Per consegna nucleare delle droghe, coniugazione di peptide tag come localizzazione nucleare (NLS) di segnali4,5,6 è stato ampiamente studiato. Tuttavia, al fine di ridurre gli effetti collaterali indesiderati, controllo spazio-temporale della traslocazione nucleare è necessario.
In precedenza, ha attivato luce traslocazione delle proteine nel nucleo delle cellule è stato raggiunto utilizzando in gabbia NLS7,8,9. NLS migra nel nucleo cellulare legandosi a proteine di trasporto citoplasmico6. Nei metodi segnalati, proteine ospite NLS in gabbia del cuscinetto sono direttamente incorporati nel citoplasma di microiniezione8 o espresso nelle celle di destinazione utilizzando un codice genetico espansione tecnica9. Pertanto, un metodo che si può raggiungere sia l’assorbimento cellulare e traslocazione nucleare foto-indotta è vantaggioso per applicazioni pratiche.
Qui, descriviamo la traslocazione nucleare attivato luce di ospiti in cellule viventi utilizzando tag dendritiche colla molecolare in gabbia (Cagedcolla-R, Figura 1). Solubile in acqua molecolare Colle10,11,12,13,14,15,16,17,18 , 19 , 20 , 21 , 22 , 23 cuscinetto più pendenti Gu+ sono stati sviluppati in precedenza, cui aderiscono strettamente al proteine11,12,13,14,15, 16,17, acidi nucleici18,19,20, fosfolipide membrane21e argilla nanosheets22,23 attraverso la Formazione di ponti più sale tra loro pendenti Gu+ e oxyanionic gruppi sugli obiettivi. I pendenti di Gu+ di Cagedcolla-R sono protetti da un gruppo di photocleavable anionici, nitroveratryloxycarbonyl butirrato-sostituiti (BANVOC). Gli ospiti con etichettati Cagedcolla-R sono presi in vita le cellule tramite endocitosi e soggiorno in endosomi (Figura 2). Al momento photoirradiation, i gruppi NVOC BAdi Cagedcolla-R sono staccati per produrre una uncaged molecolare colla (Uncagedcolla-R) che trasportano più pendenti Gu+ , che poi facilita la migrazione dell’ospite con tag nel citoplasma seguito dal nucleo della cellula (Figura 2). Il tag di colla-R Cagedpuò essere uncaged da esposizione a UV o due-fotone vicino infrarosso (NIR) luce senza serio fototossicità. Dimostriamo la consegna nucleare spatiotemporally controllata di ospiti macromolecolari, nonché ospiti della piccolo-molecola con CagedTag colla-R, utilizzando punti quantici (QD) ed un colorante fluorescente (nitrobenzoxadiazole; NBD), rispettivamente, come esempi.
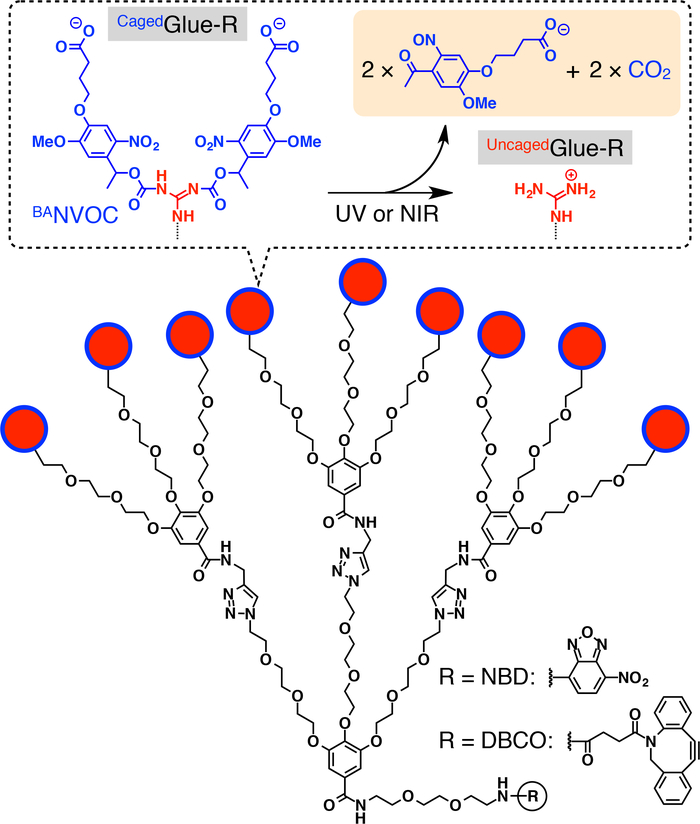
Figura 1: Strutture schematiche di Cagedcolla-R. I pendenti di ioni (Gu+) guanidinium 9 Cagedcolla-r sono protetti da un gruppo di nitroveratryloxycarbonyl butirrato-sostituiti (BANVOC). I gruppi NVOC BAsono spaccati da irradiazione con UV o luce di due fotoni NIR. Il nucleo focale della colla Caged-R è funzionalizzato con nitrobenzoxadiazole (NBD) o dibenzocylooctyne (DBCO). Ristampato con il permesso di riferimento20. Clicca qui per visualizzare una versione più grande di questa figura.
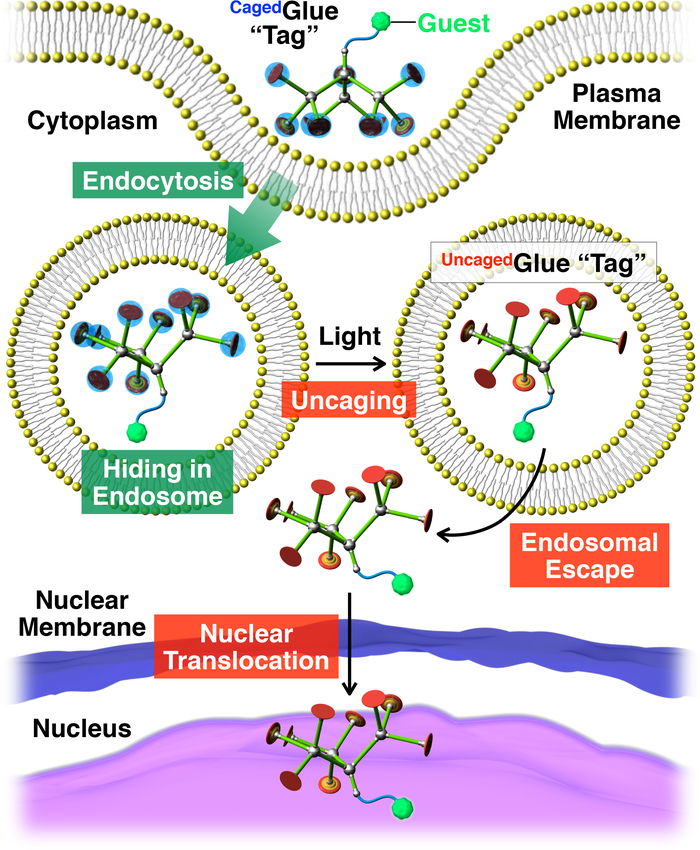
Figura 2: Illustrazione schematica della traslocazione nucleare attivato luce degli ospiti coniugato con un tag di Cagedcolla-R. L’ospite / coniugato colla-RCagedè ripreso in vita le cellule tramite endocitosi. Su photoirradiation, il tag di colla-R Cagedè uncaged cedere un tag colla-R Uncaged, che può facilitare la fuga endosomal dell’ospite con tag. Successivamente, l’ospite con tag migra nel nucleo cellulare. Ristampato con il permesso di riferimento20. Clicca qui per visualizzare una versione più grande di questa figura.
Protocol
Representative Results
Discussion
Le indagini precedenti di luce-attivato traslocazione delle proteine nel nucleo delle cellule sono stati raggiunti utilizzando in gabbia NLS7,8,9. Come accennato in precedenza, questi metodi richiedono tecniche aggiuntive per incorporare le proteine NLS-etichettate nel citoplasma. Al contrario, nostro tag colla-R Cagedconsente non solo la traslocazione nucleare indotta da foto, ma anche l’assorbimento cellulare degli …
Disclosures
The authors have nothing to disclose.
Acknowledgements
Riconosciamo il centro per l’integrazione di NanoBio, l’Università di Tokyo. Questo lavoro è stato supportato da sovvenzione per giovani scienziati (B) (26810046) per K.O. e parzialmente supportato da sovvenzione per ricerca promosso appositamente (25000005) con T.A. R.M. grazie Research Fellowships di Japan Society per la promozione della scienza (JSPS ) per giovani ricercatori e il programma per scuole laureate leader (GPLLI).
Materials
| Azide-PEG4-NHS ester | Click Chemistry Tools | AZ103 | |
| Q-dot 655 ITK | Invitrogen | Q21521MP | |
| Regenerated cellulose membrane (MWCO 3,500) | NIPPON Genetics | TOR-3K | |
| Regenerated cellulose membrane (MWCO 25,000) | Harvard Apparatus | 7425-RC25K | |
| Hep3B Cells | ATCC | HB-8064 | |
| 8-chambered glass substrate | Nunc | 155411JP | |
| 96-well culture plate | Nunc | 167008 | |
| Eagle's minimal essential medium (EMEM) | Thermo Fisher Scientific | 10370-021 | |
| Fetal bovine serum (FBS) | GE Healthcare | SH30406.02 | |
| Dulbecco's phosphate buffer saline (D-PBS) | Wako Pure Chemical Industries | 045-29795 | |
| LysoTracker Red | Lonza Walkersville | PA-3015 | |
| Hoechst 33342 | Dojindo | H342 | |
| Cell Counting Kit-8 | Dojindo | CK04 | |
| Confocal laser scanning microscope | Carl-Zeiss | LSM 510 | Equipped with two-photon excitation laser (Mai Tai laser, Spectra-Physics) |
| Confocal laser scanning microscope | Leica | TCS SP8 | |
| Xenon light source | Asahi Spectra | LAX-102 | |
| Microplate reader | Molecular Devices | SpectraMax Paradigm |
References
- Miller, A. D. Human gene therapy comes of age. Nature. 357, 455-460 (1992).
- Roth, J. A., Cristiano, R. J. Gene Therapy for Cancer: What Have We Done and Where Are We Going. Journal of the National Cancer Institute. 89, 21-39 (1997).
- Verma, I. M., Weitzman, M. D. GENE THERAPY: Twenty-First Century Medicine. Annual Review of Biochemistry. 74, 711-738 (2005).
- Ragin, A. D., Morgan, R. A., Chmielewski, J. Cellular Import Mediated by Nuclear Localization Signal Peptide Sequences. Chemistry & Biology. 9, 943-948 (2002).
- Martin, R. M., et al. Principles of protein targeting to the nucleolus. Nucleus. 6, 314-325 (2015).
- Sun, Y., et al. Factors influencing the nuclear targeting ability of nuclear localization signals. Journal of Drug Targeting. 24, 927-933 (2016).
- Ventura, B. D., Kuhlman, B. Go in! Go out! Inducible control of nuclear localization. Current Opinion in Chemical Biology. 34, 62-71 (2016).
- Watai, Y., Sase, I., Shiono, H., Nakano, Y. Regulation of nuclear import by light-induced activation of caged nuclear localization signal in living cells. FEBS Letters. 488, 39-44 (2001).
- Engelke, H., Chou, C., Uprety, R., Jess, P., Deiters, A. Control of Protein Function through Optochemical Translocation. ACS Synthetic Biology. 3, 731-736 (2014).
- Mogaki, R., Hashim, P. K., Okuro, K., Aida, T. Guanidinium-based "molecular glues" for modulation of biomolecular functions. Chemical Society Reviews. 46, 6480-6491 (2017).
- Okuro, K., Kinbara, K., Tsumoto, K., Ishii, N., Aida, T. Molecular Glues Carrying Multiple Guanidinium Ion Pendants via an Oligoether Spacer: Stabilization of Microtubules against Depolymerization. Journal of the American Chemical Society. 131, 1626-1627 (2009).
- Okuro, K., et al. Adhesion Effects of a Guanidinium Ion Appended Dendritic "Molecular Glue" on the ATP-Driven Sliding Motion of Actomyosin. Angewandte Chemie, International Edition. 48, 3030-3033 (2010).
- Uchida, N., et al. Photoclickable Dendritic Molecular Glue: Noncovalent-to-Covalent Photochemical Transformation of Protein Hybrids. Journal of the American Chemical Society. 135, 4684-4687 (2013).
- Garzoni, M., Okuro, K., Ishii, N., Aida, T., Pavan, G. M. Structure and Shape Effects of Molecular Glue on Supramolecular Tubulin Assemblies. ACS Nano. 8, 904-914 (2014).
- Mogaki, R., Okuro, K., Aida, T. Molecular glues for manipulating enzymes: trypsin inhibition by benzamidine-conjugated molecular glues. Chemical Science. 6, 2802-2805 (2015).
- Okuro, K., Sasaki, M., Aida, T. Boronic Acid-Appended Molecular Glues for ATP-Responsive Activity Modulation of Enzymes. Journal of the American Chemical Society. 138, 5527-5530 (2016).
- Mogaki, R., Okuro, K., Aida, T. Adhesive Photoswitch: Selective Photochemical Modulation of Enzymes under Physiological Conditions. Journal of the American Chemical Society. 139, 10072-10078 (2017).
- Hashim, P. K., Okuro, K., Sasaki, S., Hoashi, Y., Aida, T. Reductively Cleavable Nanocaplets for siRNA Delivery by Template-Assisted Oxidative Polymerization. Journal of the American Chemical Society. 137, 15608-15611 (2015).
- Hatano, J., Okuro, K., Aida, T. Photoinduced Bioorthogonal 1,3-Dipolar Poly-cycloaddition Promoted by Oxyanionic Substrates for Spatiotemporal Operation of Molecular Glues. Angewandte Chemie, International Edition. 55, 193-198 (2016).
- Arisaka, A., Mogaki, R., Okuro, K., Aida, T. Caged Molecular Glues as Photoactivatable Tags for Nuclear Translocation of Guests in Living Cells. Journal of the American Chemical Society. 140, 2687-2692 (2018).
- Suzuki, Y., Okuro, K., Takeuchi, T., Aida, T. Friction-Mediated Dynamic Disordering of Phospholipid Membrane by Mechanical Motions of Photoresponsive Molecular Glue: Activation of Ion Permeation. Journal of the American Chemical Society. 134, 15273-15276 (2012).
- Wang, Q., et al. High-water-content mouldable hydrogels by mixing clay and a dendritic molecular binder. Nature. 463, 339-343 (2010).
- Tamesue, S., et al. Linear versus Dendritic Molecular Binders for Hydrogel Network Formation with Clay Nanosheets: Studies with ABA Triblock Copolyethers Carrying Guanidinium Ion Pendants. Journal of the American Chemical Society. 135, 15650-15655 (2013).
- Mohr, D., Frey, S., Fischer, T., Güttler, T., Görlich, D. Characterisation of the passive permeability barrier of nuclear pore complexes. EMBO Journal. 28, 2541-2553 (2009).
- Best, M. D. Click Chemistry and Bioorthogonal Reactions: Unprecedented Selectivity in the Labeling of Biological Molecules. Biochemistry. 48, 6571-6584 (2009).
- Klán, P., et al. Photoremovable Protecting Groups in Chemistry and Biology: Reaction Mechanisms and Efficacy. Chemical Reviews. 113, 119-191 (2013).

