화학 프로브 기반 면역 분석제사용 KDM1A 표적 결합의 직접 측정
Summary
여기서, 우리는 KDM1A 억제물로 처리된 인간 또는 동물 세포, 조직 또는 혈액 샘플에서 KDM1A 표적 결합을 측정하는 프로토콜을 제시한다. 이 프로토콜은 무료 KDM1A 효소의 화학 프로브 태깅및 화학 프로브 기반 면역 검술을 사용하여 표적 직업의 직접 정량화를 채택하고 전임상 및 임상 연구에서 사용될 수 있습니다.
Abstract
표적 참여의 평가는, 그것이 디자인된 단백질과 약의 상호 작용으로 정의되고, 약 개발 또는 기초 연구 프로젝트에서 어떤 화합물든지의 생물학 활동의 해석을 위한 기본적인 필요조건입니다. 후성 유전학에서, 표적 약혼은 표적에 화합물의 결합을 측정하는 대신 프록시 마커의 분석에 의해 가장 수시로 평가됩니다. 분석된 다운스트림 생물학적 판독은 히스톤 마크 변조 또는 유전자 발현 변화를 포함한다. KDM1A는 유전자 발현의 침묵과 관련된 변형인 모노-및 디메틸화된 H3K4로부터 메틸기를 제거하는 리신 데메틸라제이다. 프록시 마커의 변조는 조사된 세포의 유전적 구성의 세포 유형 및 기능에 의존하며, 이는 해석 및 교차 사례 비교를 매우 어렵게 만들 수 있다. 이러한 문제를 회피하기 위해, 직접 KDM1A 표적 참여의 투여 량 효과 및 역학을 평가하기 위한 다목적 프로토콜이 제시된다. 기재된 분석시험은 KDM1A 화학프로브를 사용하여 억제되지 않은 효소를 포착하고 정량화하고, 유전자 변형없이 세포 또는 조직 샘플에 광범위하게 적용될 수 있으며, 우수한 검출 창을 가지며, 기초 연구에 모두 사용될 수 있습니다. 임상 샘플의 분석.
Introduction
리신 특이적 데메틸라제 1(KDM1A)은 유전자 전사의 조절에 관여하는 데메틸라제이다. 이 단백질은 종양학에서 후보 약리학적 표적 2로 나타났다; 급성 골수성 백혈병을 포함3 (AML), 골수 형성증 증후군 (MDS)4,골수 섬유증 (MF)5,6,소세포 폐암 (SCLC)7; 겸상적혈구 (SCD)8,9,및 알츠하이머 병 (AD), 다발성 경화증 (MS)을 포함한 중추 신경계 질환에서; 그리고 침략10.
임상 개발에서 KDM1A 억제 화합물의 대부분은 사이클로프로필라민 유도체이며 플라빈 아데닌 디뉴클레오티드(FAD) 보조인자(FAD)에 공유 결합함으로써 단백질을 억제한다. KDM1A의 억제는 유전자 발현 변경을 유도합니다, 그러나 이 변경은 조직, 세포 모형, 또는 질병 케이스에 걸쳐 엄청나게 변화합니다. KDM1A의 억제는 또한 히스톤마크(12)를 변화시지만, 이러한 변화는 일반적으로 게놈내의 특정 부위에서 국소적으로 생성되고, 다시, 고도로 조직 및 세포 특이적이다.
이 프로토콜은 생물학적 샘플에서 KDM1A 표적 참여를 직접 측정하기 위해 개발되었으며 사이클로프로필라민 유래 억제제와 함께 사용하기 위해 최적화되었습니다. 상기 분석은 ELISA 기술을 기반으로 하고, 고체 상 분석에서 생물학적 시료로부터의 네이티브 단백질 추출물에서 총 및 자유(즉, 억제제에 의한 언바운드) KDM1A를 병렬로 분석한다. 첫 번째 단계로서, 생물학적 시료는 생물학적 KDM1A 선택적 화학프로브 OG-88113,14,선택적 KDM1A 억제제 ORY-1001(iadademstat) 임상에서 KDM1A의 강력한 억제제로부터 유래된 생체질화 된 KDM1A의 존재로부터 용해된다. 종양학 질환의 치료를위한 개발. 상기 화학프로브는 120 nM의 KDM1A에 대한 IC 50을 가지며, 생체연화된 폴리에틸렌 글리콜(PEG)-꼬리에 연결된 FAD 결합 모티프를 포함한다. 화학 프로브는 자유 KDM1A에 독점적으로 결합하지만, 샘플내의 억제제 결합 KDM1A에는 결합하지 않는다. 화학 프로브 결합 후, 샘플에 복합체를 포함하는 KDM1A는 스크렙타비딘 코팅 표면이있는 마이크로 티터 플레이트에서 포착되어 무료 KDM1A를 결정하거나 단일 클론 안티 KDM1A 캡처 항체로 코팅된 플레이트에서 총 KDM1A를 결정합니다. 세척 후, 두 플레이트는 항 KDM1A 검출 항체로 배양되고, 다시 세척하고, 상대적 측정에 의해 발광 기질 및 정량화를 사용하여 검출을 위한 이차 HRP-컨쥬게이트 당나귀 반토끼 IgG 항체로 배양 광도계(그림 1)에서 라이트 유닛(RLU)을 표시합니다.
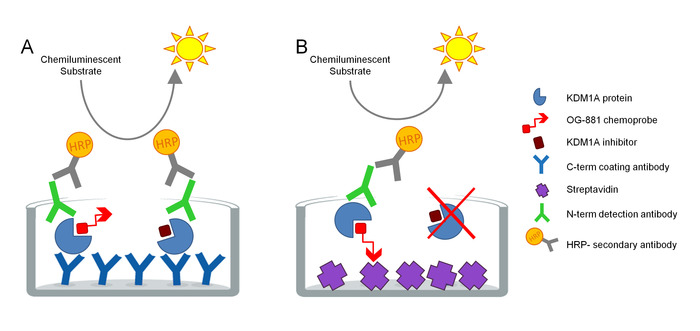
그림 1. ELISA 효소의 스키마 는 KDM1A 표적 결합을 위한 화학프로브 면역흡수제 분석과 연결: A) 샌드위치 ELISA 및 B를 이용한 총 KDM1A의 측정체ELISA를 이용한 자유 KDM1A의 측정. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
표준 곡선은 각 분석법의 선형성을 확인하기 위해 두 ELISA 플레이트에 포함되어 있습니다. 각 샘플에서 KDM1A 표적 결합의 측정은 사전 투여량 또는 비구시 처리 샘플에 대한 상대값으로 계산된다.
Protocol
Representative Results
Discussion
여기에 제시된 프로토콜은 새로운 KDM1A 화학프로브 포획 기반 ELISA를 사용하여 KDM1A 표적 참여를 직접 측정하기 위해 개발되었다. 이 방법은 인간, 쥐 및 마우스 및 개코원숭이(PBMC, 폐, 뇌, 피부, 종양 포함)에서 배양된 인간 세포주 및 생체 내 샘플에서 검증되었지만, KDM1A 항체 표적 에피토프 및 촉매가 있는 다른 종에 쉽게 적용할 수 있습니다. 센터가 보존됩니다. OG-881은 활성 기반 의 화학 프로브?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
이 연구는 오리존 유전체학에 의해 융자되었다. S.A., 호프만 라 로슈, 부분적으로 CIIP-20152001 및 RETOS 협력 프로그램 RTC-2015-3332-1에 의해 지원.
Materials
| 0,05% Trypsin-EDTA (1X) | Thermo Scientific | #25300-062 | |
| 10 X Protease Inhibitor Tablets | Roche | #11836153001 | |
| 96 deep well storage block | VWR | #734-1679 | |
| 96 well ELISA plates | Nunc | #436110 | |
| Adhesive black Film | Perkin Elmer | #6050173 | |
| Adhesive transparent Film | VWR | #60941-062 | |
| Biotinylated KDM1A probe OG-881 | Oryzon Genomics S.A. | NA | |
| Bovine Serum Albumin | Sigma | # 3117057001 | |
| Bovine Serum Albumin Standard | Thermo Scientific | #23208) | |
| Bradford Protein Assay | BioRad | #500-0001 | |
| Cell lysis buffer 10X | Cell Signaling | #9803 | |
| Centrifuge for 96- well plates | Hettich | Rotina 420R | |
| Flask | Thermo Scientific | #156499 | |
| Full length, enzymatically active human Recombinant LSD1 / KDM1A | Active Motif | #31426 | |
| Graphpad Prism 5 Project | GraphPad Software | NA | |
| Luminol-Enhacer and Peroxide Solution (Chemiluminescent Substrate) | Thermo Scientific | #37074 | |
| Micro Centrifuge | Eppendorf | 5415 R | |
| Microplate reader Infinite 200-Tecan | Tecan | Infinite 200 | |
| Mouse monoclonal capture antibody Anti-KDM1A (N-terminal epitope) | Abcam | #ab53269 | |
| Needle G18 gauge blunt | BD | #303129 | |
| ORY-1001 (iadademstat) | Oryzon Genomics S.A. | NA | |
| PBMC separation tubes 10 ml | Greiner bio-one | #163288 | |
| PBMC separation tubes 50 ml | Greiner bio-one | #227288 | |
| PBS 1x | Sigma | #D8537 | |
| Plate shaker | Heidolph Instruments | Rotamax 120 | |
| Polysorbate 20 | Sigma | #P7949 | |
| Rabbit monoclonal detection antibody Anti-KDM1A (C-terminal epitope) | Cell Signaling | #672184BF-100 | |
| Secondary antibody Peroxidase-conjugated Donkey Anti-rabbit IgG | Thermo Scientific | #31458 | |
| Spectrophotometer cuvette 1.5 | Deltalab | #302100 | |
| Spectrophotometer for cuvette | GE Healthcare | GeneQuant 1300 | |
| Streptavidin | Promega | #Z704A | |
| Syringe | BD | #303172 | |
| Type 1 ultrapure water | Millipore | Milli-Q Advantage A10 | |
| Ultrasonic cleaner | VWR | USC200T |
References
- Shi, Y. Histone demethylation mediated by the nuclear amine oxidase homolog LSD1. Cell. 119 (7), 941-953 (2004).
- Maiques-Diaz, A., Somervaille, T. C. LSD1: biologic roles and therapeutic targeting. Epigenomics. 8 (8), 1103-1116 (2016).
- Maes, T. ORY-1001, a Potent and Selective Covalent KDM1A Inhibitor, for the Treatment of Acute Leukemia. Cancer Cell. 33 (3), 495-511 (2018).
- Sugino, N. A novel LSD1 inhibitor NCD38 ameliorates MDS-related leukemia with complex karyotype by attenuating leukemia programs via activating super-enhancers. Leukemia. 31 (11), 2303-2314 (2017).
- Kleppe, M., Shank, K., Efthymia, P., Riehnhoff, H., Levine, R. L. Lysine-Specific Histone Demethylase, LSD1, (KDM1A) As a Novel Therapeutic Target in Myeloproliferative Neoplasms. Blood. 126, 601 (2015).
- Jutzi, J. S., et al. LSD1 Inhibition Prolongs Survival in Mouse Models of MPN by Selectively Targeting the Disease Clone. HemaSphere. 2 (3), 54 (2018).
- Mohammad, H. P. DNA Hypomethylation Signature Predicts Antitumor Activity of LSD1 Inhibitors in SCLC. Cancer Cell. 28 (1), 57-69 (2015).
- Rivers, A., et al. RN-1, a potent and selective lysine-specific demethylase 1 inhibitor, increases γ-globin expression, F reticulocytes, and F cells in a sickle cell disease mouse model. Experimental Hematology. 43 (7), 546-553 (2015).
- Rivers, A. Oral administration of the LSD1 inhibitor ORY-3001 increases fetal hemoglobin in sickle cell mice and baboons. Experimental Hematology. 67, 60-64 (2018).
- Buesa, C., et al. The dual LSD1/MAO-B inhibitor ORY-2001 prevents the development of the memory deficit in samp8 mice through induction of neuronal plasticity and reduction of neuroinflammation. Alzheimer’s & Dementia. 11 (7), P905 (2015).
- Schmidt, D. M., McCafferty, D. G. Trans-2-Phenylcyclopropylamine is a mechanism-based inactivator of the histone demethylase LSD1. Biochemistry. 46 (14), 4408-4416 (2007).
- Forneris, F., Binda, C., Vanoni, M. A., Battaglioli, E., Mattevi, A. Human histone demethylase LSD1 reads the histone code. Journal of Biological Chemistry. 280 (50), 41360-41365 (2005).
- Gonz#225;lez, E. C., Maes, T., Crusat, C. M., Mu#241;oz, A. O. Oryzon Genomics, Methods to determine kdm1a target engagement and chemoprobes useful therefor. , (2016).
- Mascaró, C., Ortega, A., Carceller, E., Rruiz Rodriguez, R., Cicero, F., Lunardi, S., Yu, L., Hilbert, M., Maes, T. Chemoprobe-based assays of histone lysine demethylase 1A target occupation enable in vivo pharmacokinetics and -dynamics studies of KDM1A inhibitors. Journal of Biological Chemistry. , (2019).
- Rodriguez-Suarez, R. Development of Homogeneous Nonradioactive Methyltransferase and Demethylase Assays Targeting Histone H3 Lysine 4. Journal of Biomolecular Screening. 17 (1), 49-58 (2011).
- Lynch, J. T., Cockerill, M. J., Hitchin, J. R., Wiseman, D. H., Somervaille, T. C. CD86 expression as a surrogate cellular biomarker for pharmacological inhibition of the histone demethylase lysine-specific demethylase 1. Analytical Biochemistry. 442 (1), 104-106 (2013).
- Schulz-Fincke, J. Structure-activity studies on N-Substituted tranylcypromine derivatives lead to selective inhibitors of lysine specific demethylase 1 (LSD1) and potent inducers of leukemic cell differentiation. European Journal of Medicinal Chemistry. 144, 52-67 (2018).
- Ishii, T., et al. CETSA quantitatively verifies in vivo target engagement of novel RIPK1 inhibitors in various biospecimens. Scientific Report. 7, 13000 (2017).
- Maes, T. ORY-2001: An Epigenetic drug for the treatment of cognition defects in Alzheimer’s disease and other neurodegenerative disorders. Alzheimer’s & Dementia. 12 (7), P1192 (2017).

