Прямое измерение целевого взаимодействия KDM1A с использованием иммуноанализов на основе хемозондов
Summary
Здесь мы представляем протокол для измерения участия kDM1A в клетках человека или животного, тканях или образцах крови, обработанных ингибиторами KDM1A. Протокол использует хемозонд маркировки свободного фермента KDM1A и прямой количественной оценки целевого занятия с использованием химиозонда на основе иммуноанализов и могут быть использованы в доклинических и клинических исследованиях.
Abstract
Оценка целевого взаимодействия, определяемого как взаимодействие препарата с разработанным для него белком, является основным требованием для интерпретации биологической активности любого соединения при разработке лекарств или в фундаментальных исследовательских проектах. В эпигенетике целевое взаимодействие чаще всего оценивается путем анализа прокси-маркеров вместо измерения соединения с целью. Ниже по течению биологических считывания, которые были проанализированы включают гистон знак модуляции или изменения экспрессии генов. KDM1A является лизин деметилаза, которая удаляет метиловые группы из моно- и диметилированного H3K4, модификация, связанная с глушинием экспрессии генов. Модуляция прокси-маркеров зависит от типа клеток и функции генетического состава исследуемых клеток, что может сделать интерпретацию и сравнение кросс-кейса довольно трудным. Для обхода этих проблем представлен универсальный протокол для оценки эффектов дози и динамики прямого целевого взаимодействия КДМ1А. Анализ описано использует KDM1A хемозонд для захвата и количественно раскованный фермент, может быть широко применяется к клеткам или образцам тканей без необходимости генетической модификации, имеет отличное окно обнаружения, и может быть использован как для фундаментальных исследований и анализ клинических образцов.
Introduction
Лизин специфическая деметилаза 1 (KDM1A)1 является деметилазой, участвующих в контроле транскрипции генов. Этот белок стал кандидатом фармакологических целевой2 в онкологии; в том числе острый миелоидный лейкоз3 (AML), Синдром миелодисплазии (MDS)4, миелофиброз (MF)5,6, Малый рак легких (SCLC)7; при серповидно-клеточной болезни (SCD)8,9, и при заболеваниях центральной нервной системы, включая болезнь Альцгеймера (Ад), рассеянный склероз (Ms); и в агрессии10.
Большинство ингибирующих соединений KDM1A в клиническом развитии являются производными циклопропиламина и ингибируют белок ковалентным связыванием с его лавина аденин динуклеотид (FAD) кофактор11. Ингибирование KDM1A вызывает изменения экспрессии генов, но эти изменения сильно различаются по тканям, типам клеток или случаям заболевания. Ингибиция KDM1A также изменяет признаки гистона12, но эти изменения, как правило, производятся локально на определенном участке в геноме, и снова, высоко ткани и клеток конкретных.
Протокол был разработан для непосредственного измерения целевого участия KDM1A в биологических образцах и был оптимизирован для использования с ингибиторами производных циклопропиламина. Анализ основан на технологии ELISA и анализирует, параллельно, Total и Free (т.е. не связанный ингибитором) KDM1A в родном белковом экстракте из биологического образца в твердой фазе анализа. В качестве первого шага, биологический образец лизируется в присутствии биотинилапопром KDM1A селективного хемозонда OG-88113,14, полученных из селективного ингибитора KDM1A ORY-1001 (iadademstat), мощный ингибитор KDM1A в клинических развитие для лечения онкологических заболеваний. Химиозонд имеет IC50 для KDM1A 120 нм и включает в себя ФАД связывающий муаети, связанный с биотинилатированным полиэтиленовым гликолем (PEG).-хвост. Химиозонд исключительно связывается с свободным KDM1A, но не с ингибитором KDM1A в образце. После привязки хемозонда, KDM1A, содержащие комплексы в образце, фиксируются на микротитерных пластинах с стрептавидиновой поверхностью с покрытием для определения свободного KDM1A, или на пластинах, покрытых моноклональным анти-KDM1A захвата антитела для определения общего KDM1A. После мытья, обе пластины инкубируются антителами обнаружения к KDM1A, промывают снова и инкубируются вторичным HRP-конъюгированным антикроликом IgG антитела для обнаружения с помощью люминесцентного субстрата и количественной оценки путем измерения относительного световые единицы (RLU) в люминометре(рисунок 1).
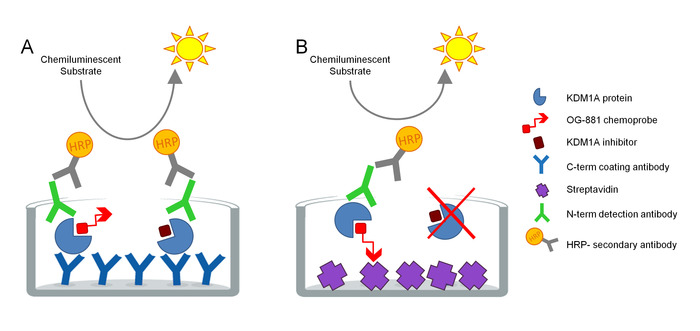
Рисунок 1. Схема ELISA Enzyme связана химиозонд иммуноабсорбент анализа для KDM1A целевого участия: A) Определение общего KDM1A с использованием бутерброда ELISA и B) Определение бесплатного KDM1A с использованием химиозонда ELISA. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Стандартная кривая включена в обе пластины ELISA для проверки линейности каждого анализа. Определение целевого участия KDM1A в каждой выборке затем рассчитывается как относительная стоимость предварительной дозы или образца, обработанного транспортным средством.
Protocol
Representative Results
Discussion
Представленный здесь протокол был разработан для непосредственного измерения целевого взаимодействия KDM1A с помощью нового хемозонда KDM1A, основанного на ELISA. Метод был проверен на культивированных человеческих клеточных линий и ex vivo образцов из человека, крысы и мыши и бабуина (в том чи?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Это исследование было профинансировано Oryzon Genomics. S.A., Hoffman-La Roche, и частично поддерживается CIIP-20152001 и RETOS программы сотрудничества RTC-2015-3332-1.
Materials
| 0,05% Trypsin-EDTA (1X) | Thermo Scientific | #25300-062 | |
| 10 X Protease Inhibitor Tablets | Roche | #11836153001 | |
| 96 deep well storage block | VWR | #734-1679 | |
| 96 well ELISA plates | Nunc | #436110 | |
| Adhesive black Film | Perkin Elmer | #6050173 | |
| Adhesive transparent Film | VWR | #60941-062 | |
| Biotinylated KDM1A probe OG-881 | Oryzon Genomics S.A. | NA | |
| Bovine Serum Albumin | Sigma | # 3117057001 | |
| Bovine Serum Albumin Standard | Thermo Scientific | #23208) | |
| Bradford Protein Assay | BioRad | #500-0001 | |
| Cell lysis buffer 10X | Cell Signaling | #9803 | |
| Centrifuge for 96- well plates | Hettich | Rotina 420R | |
| Flask | Thermo Scientific | #156499 | |
| Full length, enzymatically active human Recombinant LSD1 / KDM1A | Active Motif | #31426 | |
| Graphpad Prism 5 Project | GraphPad Software | NA | |
| Luminol-Enhacer and Peroxide Solution (Chemiluminescent Substrate) | Thermo Scientific | #37074 | |
| Micro Centrifuge | Eppendorf | 5415 R | |
| Microplate reader Infinite 200-Tecan | Tecan | Infinite 200 | |
| Mouse monoclonal capture antibody Anti-KDM1A (N-terminal epitope) | Abcam | #ab53269 | |
| Needle G18 gauge blunt | BD | #303129 | |
| ORY-1001 (iadademstat) | Oryzon Genomics S.A. | NA | |
| PBMC separation tubes 10 ml | Greiner bio-one | #163288 | |
| PBMC separation tubes 50 ml | Greiner bio-one | #227288 | |
| PBS 1x | Sigma | #D8537 | |
| Plate shaker | Heidolph Instruments | Rotamax 120 | |
| Polysorbate 20 | Sigma | #P7949 | |
| Rabbit monoclonal detection antibody Anti-KDM1A (C-terminal epitope) | Cell Signaling | #672184BF-100 | |
| Secondary antibody Peroxidase-conjugated Donkey Anti-rabbit IgG | Thermo Scientific | #31458 | |
| Spectrophotometer cuvette 1.5 | Deltalab | #302100 | |
| Spectrophotometer for cuvette | GE Healthcare | GeneQuant 1300 | |
| Streptavidin | Promega | #Z704A | |
| Syringe | BD | #303172 | |
| Type 1 ultrapure water | Millipore | Milli-Q Advantage A10 | |
| Ultrasonic cleaner | VWR | USC200T |
References
- Shi, Y. Histone demethylation mediated by the nuclear amine oxidase homolog LSD1. Cell. 119 (7), 941-953 (2004).
- Maiques-Diaz, A., Somervaille, T. C. LSD1: biologic roles and therapeutic targeting. Epigenomics. 8 (8), 1103-1116 (2016).
- Maes, T. ORY-1001, a Potent and Selective Covalent KDM1A Inhibitor, for the Treatment of Acute Leukemia. Cancer Cell. 33 (3), 495-511 (2018).
- Sugino, N. A novel LSD1 inhibitor NCD38 ameliorates MDS-related leukemia with complex karyotype by attenuating leukemia programs via activating super-enhancers. Leukemia. 31 (11), 2303-2314 (2017).
- Kleppe, M., Shank, K., Efthymia, P., Riehnhoff, H., Levine, R. L. Lysine-Specific Histone Demethylase, LSD1, (KDM1A) As a Novel Therapeutic Target in Myeloproliferative Neoplasms. Blood. 126, 601 (2015).
- Jutzi, J. S., et al. LSD1 Inhibition Prolongs Survival in Mouse Models of MPN by Selectively Targeting the Disease Clone. HemaSphere. 2 (3), 54 (2018).
- Mohammad, H. P. DNA Hypomethylation Signature Predicts Antitumor Activity of LSD1 Inhibitors in SCLC. Cancer Cell. 28 (1), 57-69 (2015).
- Rivers, A., et al. RN-1, a potent and selective lysine-specific demethylase 1 inhibitor, increases γ-globin expression, F reticulocytes, and F cells in a sickle cell disease mouse model. Experimental Hematology. 43 (7), 546-553 (2015).
- Rivers, A. Oral administration of the LSD1 inhibitor ORY-3001 increases fetal hemoglobin in sickle cell mice and baboons. Experimental Hematology. 67, 60-64 (2018).
- Buesa, C., et al. The dual LSD1/MAO-B inhibitor ORY-2001 prevents the development of the memory deficit in samp8 mice through induction of neuronal plasticity and reduction of neuroinflammation. Alzheimer’s & Dementia. 11 (7), P905 (2015).
- Schmidt, D. M., McCafferty, D. G. Trans-2-Phenylcyclopropylamine is a mechanism-based inactivator of the histone demethylase LSD1. Biochemistry. 46 (14), 4408-4416 (2007).
- Forneris, F., Binda, C., Vanoni, M. A., Battaglioli, E., Mattevi, A. Human histone demethylase LSD1 reads the histone code. Journal of Biological Chemistry. 280 (50), 41360-41365 (2005).
- Gonz#225;lez, E. C., Maes, T., Crusat, C. M., Mu#241;oz, A. O. Oryzon Genomics, Methods to determine kdm1a target engagement and chemoprobes useful therefor. , (2016).
- Mascaró, C., Ortega, A., Carceller, E., Rruiz Rodriguez, R., Cicero, F., Lunardi, S., Yu, L., Hilbert, M., Maes, T. Chemoprobe-based assays of histone lysine demethylase 1A target occupation enable in vivo pharmacokinetics and -dynamics studies of KDM1A inhibitors. Journal of Biological Chemistry. , (2019).
- Rodriguez-Suarez, R. Development of Homogeneous Nonradioactive Methyltransferase and Demethylase Assays Targeting Histone H3 Lysine 4. Journal of Biomolecular Screening. 17 (1), 49-58 (2011).
- Lynch, J. T., Cockerill, M. J., Hitchin, J. R., Wiseman, D. H., Somervaille, T. C. CD86 expression as a surrogate cellular biomarker for pharmacological inhibition of the histone demethylase lysine-specific demethylase 1. Analytical Biochemistry. 442 (1), 104-106 (2013).
- Schulz-Fincke, J. Structure-activity studies on N-Substituted tranylcypromine derivatives lead to selective inhibitors of lysine specific demethylase 1 (LSD1) and potent inducers of leukemic cell differentiation. European Journal of Medicinal Chemistry. 144, 52-67 (2018).
- Ishii, T., et al. CETSA quantitatively verifies in vivo target engagement of novel RIPK1 inhibitors in various biospecimens. Scientific Report. 7, 13000 (2017).
- Maes, T. ORY-2001: An Epigenetic drug for the treatment of cognition defects in Alzheimer’s disease and other neurodegenerative disorders. Alzheimer’s & Dementia. 12 (7), P1192 (2017).

