القياس المباشر للمشاركة المستهدفة KDM1A باستخدام الاختبارات المناعية المستندة إلى العلاج الكيميائي
Summary
هنا، نقدم بروتوكوللقياس المشاركة المستهدفة KDM1A في خلية بشرية أو حيوانية، أو أنسجة أو عينات دم عولجت بمثبطات KDM1A. يستخدم البروتوكول وضع علامات المسبار الكيميائي لإنزيم KDM1A المجاني والتحديد الكمي المباشر للمهنة المستهدفة باستخدام الاختبارات المناعية المستندة إلى العلاج الكيميائي ويمكن استخدامها في الدراسات ما قبل السريرية والسريرية.
Abstract
وتقييم المشاركة المستهدفة، التي تعرف بأنها تفاعل دواء مع البروتين الذي صمم له، هو شرط أساسي لتفسير النشاط البيولوجي لأي مركب في تطوير المخدرات أو في مشاريع البحوث الأساسية. في علم الوراثة، يتم تقييم المشاركة المستهدفة في معظم الأحيان عن طريق تحليل علامات الوكيل بدلاً من قياس اتحاد المركب إلى الهدف. تتضمن التبيّات البيولوجية في المصب التي تم تحليلها تعديل علامة الهيستون أو تغييرات التعبير الجيني. KDM1A هو demethylase يسين الذي يزيل مجموعات الميثيل من H3K4 أحادية وثنائية الميثيل، وهو تعديل يرتبط بإسكات التعبير الجيني. تعديل علامات الوكيل يعتمد على نوع الخلية ووظيفة التركيبة الوراثية للخلايا التي تم التحقيق فيها، والتي يمكن أن تجعل التفسير والمقارنة بين الحالات صعبة للغاية. وللتحايل على هذه المشاكل، يتم تقديم بروتوكول متعدد الاستخدامات لتقييم آثار الجرعة وديناميات المشاركة المستهدفة المباشرة في KDM1A. الفحص الموصوف يجعل استخدام مسبار كيميائي KDM1A لالتقاط وقياس الإنزيم غير المثبط، ويمكن تطبيقه على نطاق واسع على الخلايا أو عينات الأنسجة دون الحاجة إلى التعديل الوراثي، لديه نافذة ممتازة للكشف، ويمكن استخدامها على حد سواء للبحوث الأساسية وتحليل العينات السريرية.
Introduction
ليسين demethylase محددة 1 (KDM1A)1 هو demethylase تشارك في السيطرة على النسخ الجيني. وقد برز هذا البروتين كهدف الدوائية المرشح2 في علم الأورام; بما في ذلك سرطان الدم النقوي الحاد3 (AML), متلازمة خلل التنسج النقوي (MDS)4, التليف النقوي (MF)5,6, سرطان الرئة الخلية الصغيرة (SCLC)7; في مرض الخلايا المنجلية (SCD)8،9، وفي أمراض الجهاز العصبي المركزي بما في ذلك مرض الزهايمر (AD)، التصلب المتعدد (MS)؛ وفي العدوان10.
معظم المركبات المثبطة KDM1A في التنمية السريرية هي مشتقات السيكلوبروبيلان وتمنع البروتين عن طريق ربط covalent إلى الفلافين الدينوكليوتيد (FAD) عامل مساعد11. تثبيط KDM1A يحفز تغييرات التعبير الجيني، ولكن هذه التغييرات تختلف اختلافا كبيرا عبر الأنسجة، وأنواع الخلايا، أو حالات المرض. تثبيط KDM1A أيضا يغير علامات الهيستون12،ولكن يتم إنتاج هذه التغييرات عموما محليا في موقع معين في الجينوم، ومرة أخرى، والأنسجة العالية والخلية محددة.
وقد تم تطوير البروتوكول لقياس المشاركة المستهدفة KDM1A مباشرة في العينات البيولوجية، وقد تم تحسينه للاستخدام مع مثبطات سيكلوبروبيلامين المشتقة. ويستند هذا التقييم على تكنولوجيا ELISA ويحلل، في موازاة ذلك، توتال وفري (أي غير مقيدة بمثبط) KDM1A في استخراج البروتين الأصلي من عينة بيولوجية في اختبار مرحلة صلبة. وكخطوة أولى، يتم تحليل العينة البيولوجية في وجود البكيويند KDM1A الانتقائي ة العلاج الكيميائي OG-88113،14،المستمدة من مثبطات KDM1A الانتقائية ORY-1001 (iadademstat)، وهو مثبط قوي من KDM1A في السريرية تطوير لعلاج أمراض الأورام. يحتوي المسبار الكيميائي على50 IC لKDM1A من 120 nM ويشمل moiety ملزمة FAD مرتبطة بالبولي ايثيلين غليكول biotinylated (PEG) الذيل. يرتبط المسبار الكيميائي حصريًا بـ KDM1A المجاني، ولكن ليس بـ KDM1A المثبط في العينة. بعد ربط المسبار الكيميائي، يتم التقاط المجمعات التي تحتوي على KDM1A في العينة على لوحات ميكروتيدر مع سطح مطلي streptavidin لتحديد KDM1A مجانا، أو على لوحات مغلفة مع الأجسام المضادة أحادية النسيلة المضادة لKDM1A التقاط لتحديد مجموع KDM1A. بعد الغسيل، يتم احتضان كلا اللوحتين بجسم مضاد للكشف المضاد لـ KDM1A، وغسلهما مرة أخرى، واحتضنهما بجسم مضاد للأرنب مضاد للأرانب من نوع HRP-conju،( HRP-conju/ لكشفه باستخدام الركيزة المضيئة والقياس الكمي عن طريق قياس النسبية وحدات الضوء (RLU) في مقياسالإنارة (الشكل 1).
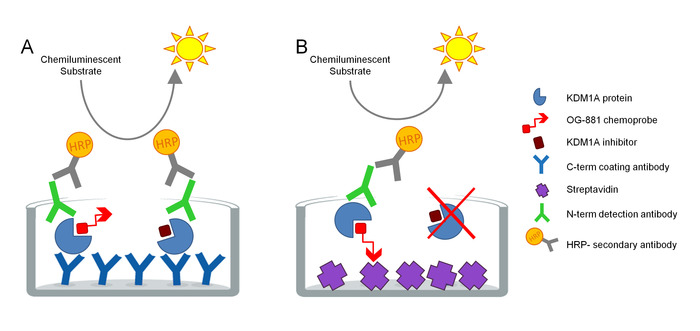
الشكل 1 مخطط إنزيم إليسا مرتبط بالفحص المناعي الكيموبي للمشاركة المستهدفة KDM1A: أ) تحديد إجمالي KDM1A باستخدام ساندويتش ELISA و B) تحديد KDM1A مجانا باستخدام العلاج الكيميائي ELISA. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
يتم تضمين منحنى قياسي في كل من لوحات ELISA للتحقق من خطية كل مستوى. ثم يتم حساب تحديد المشاركة المستهدفة KDM1A في كل عينة كقيمة نسبية للعينة قبل الجرعة أو السيارة المعالجة.
Protocol
Representative Results
Discussion
تم تطوير البروتوكول المعروض هنا لقياس المشاركة المستهدفة KDM1A مباشرة باستخدام رواية القبض على المسبار الكيميائي KDM1A مقرها ELISA. وقد تم التحقق من صحة هذه الطريقة على خطوط الخلايا البشرية المستزرعة وعينات الجسم الحي السابق من الإنسان والفئران والفأر والبابون (بما في ذلك PBMCs والرئة والدماغ وال…
Disclosures
The authors have nothing to disclose.
Acknowledgements
تم تمويل هذه الدراسة من قبل أورزون جينوميكس. S.A., هوفمان لاروش, وبدعم جزئي من CIIP-20152001 وRETOS برنامج التعاون RTC-2015-3332-1.
Materials
| 0,05% Trypsin-EDTA (1X) | Thermo Scientific | #25300-062 | |
| 10 X Protease Inhibitor Tablets | Roche | #11836153001 | |
| 96 deep well storage block | VWR | #734-1679 | |
| 96 well ELISA plates | Nunc | #436110 | |
| Adhesive black Film | Perkin Elmer | #6050173 | |
| Adhesive transparent Film | VWR | #60941-062 | |
| Biotinylated KDM1A probe OG-881 | Oryzon Genomics S.A. | NA | |
| Bovine Serum Albumin | Sigma | # 3117057001 | |
| Bovine Serum Albumin Standard | Thermo Scientific | #23208) | |
| Bradford Protein Assay | BioRad | #500-0001 | |
| Cell lysis buffer 10X | Cell Signaling | #9803 | |
| Centrifuge for 96- well plates | Hettich | Rotina 420R | |
| Flask | Thermo Scientific | #156499 | |
| Full length, enzymatically active human Recombinant LSD1 / KDM1A | Active Motif | #31426 | |
| Graphpad Prism 5 Project | GraphPad Software | NA | |
| Luminol-Enhacer and Peroxide Solution (Chemiluminescent Substrate) | Thermo Scientific | #37074 | |
| Micro Centrifuge | Eppendorf | 5415 R | |
| Microplate reader Infinite 200-Tecan | Tecan | Infinite 200 | |
| Mouse monoclonal capture antibody Anti-KDM1A (N-terminal epitope) | Abcam | #ab53269 | |
| Needle G18 gauge blunt | BD | #303129 | |
| ORY-1001 (iadademstat) | Oryzon Genomics S.A. | NA | |
| PBMC separation tubes 10 ml | Greiner bio-one | #163288 | |
| PBMC separation tubes 50 ml | Greiner bio-one | #227288 | |
| PBS 1x | Sigma | #D8537 | |
| Plate shaker | Heidolph Instruments | Rotamax 120 | |
| Polysorbate 20 | Sigma | #P7949 | |
| Rabbit monoclonal detection antibody Anti-KDM1A (C-terminal epitope) | Cell Signaling | #672184BF-100 | |
| Secondary antibody Peroxidase-conjugated Donkey Anti-rabbit IgG | Thermo Scientific | #31458 | |
| Spectrophotometer cuvette 1.5 | Deltalab | #302100 | |
| Spectrophotometer for cuvette | GE Healthcare | GeneQuant 1300 | |
| Streptavidin | Promega | #Z704A | |
| Syringe | BD | #303172 | |
| Type 1 ultrapure water | Millipore | Milli-Q Advantage A10 | |
| Ultrasonic cleaner | VWR | USC200T |
References
- Shi, Y. Histone demethylation mediated by the nuclear amine oxidase homolog LSD1. Cell. 119 (7), 941-953 (2004).
- Maiques-Diaz, A., Somervaille, T. C. LSD1: biologic roles and therapeutic targeting. Epigenomics. 8 (8), 1103-1116 (2016).
- Maes, T. ORY-1001, a Potent and Selective Covalent KDM1A Inhibitor, for the Treatment of Acute Leukemia. Cancer Cell. 33 (3), 495-511 (2018).
- Sugino, N. A novel LSD1 inhibitor NCD38 ameliorates MDS-related leukemia with complex karyotype by attenuating leukemia programs via activating super-enhancers. Leukemia. 31 (11), 2303-2314 (2017).
- Kleppe, M., Shank, K., Efthymia, P., Riehnhoff, H., Levine, R. L. Lysine-Specific Histone Demethylase, LSD1, (KDM1A) As a Novel Therapeutic Target in Myeloproliferative Neoplasms. Blood. 126, 601 (2015).
- Jutzi, J. S., et al. LSD1 Inhibition Prolongs Survival in Mouse Models of MPN by Selectively Targeting the Disease Clone. HemaSphere. 2 (3), 54 (2018).
- Mohammad, H. P. DNA Hypomethylation Signature Predicts Antitumor Activity of LSD1 Inhibitors in SCLC. Cancer Cell. 28 (1), 57-69 (2015).
- Rivers, A., et al. RN-1, a potent and selective lysine-specific demethylase 1 inhibitor, increases γ-globin expression, F reticulocytes, and F cells in a sickle cell disease mouse model. Experimental Hematology. 43 (7), 546-553 (2015).
- Rivers, A. Oral administration of the LSD1 inhibitor ORY-3001 increases fetal hemoglobin in sickle cell mice and baboons. Experimental Hematology. 67, 60-64 (2018).
- Buesa, C., et al. The dual LSD1/MAO-B inhibitor ORY-2001 prevents the development of the memory deficit in samp8 mice through induction of neuronal plasticity and reduction of neuroinflammation. Alzheimer’s & Dementia. 11 (7), P905 (2015).
- Schmidt, D. M., McCafferty, D. G. Trans-2-Phenylcyclopropylamine is a mechanism-based inactivator of the histone demethylase LSD1. Biochemistry. 46 (14), 4408-4416 (2007).
- Forneris, F., Binda, C., Vanoni, M. A., Battaglioli, E., Mattevi, A. Human histone demethylase LSD1 reads the histone code. Journal of Biological Chemistry. 280 (50), 41360-41365 (2005).
- Gonz#225;lez, E. C., Maes, T., Crusat, C. M., Mu#241;oz, A. O. Oryzon Genomics, Methods to determine kdm1a target engagement and chemoprobes useful therefor. , (2016).
- Mascaró, C., Ortega, A., Carceller, E., Rruiz Rodriguez, R., Cicero, F., Lunardi, S., Yu, L., Hilbert, M., Maes, T. Chemoprobe-based assays of histone lysine demethylase 1A target occupation enable in vivo pharmacokinetics and -dynamics studies of KDM1A inhibitors. Journal of Biological Chemistry. , (2019).
- Rodriguez-Suarez, R. Development of Homogeneous Nonradioactive Methyltransferase and Demethylase Assays Targeting Histone H3 Lysine 4. Journal of Biomolecular Screening. 17 (1), 49-58 (2011).
- Lynch, J. T., Cockerill, M. J., Hitchin, J. R., Wiseman, D. H., Somervaille, T. C. CD86 expression as a surrogate cellular biomarker for pharmacological inhibition of the histone demethylase lysine-specific demethylase 1. Analytical Biochemistry. 442 (1), 104-106 (2013).
- Schulz-Fincke, J. Structure-activity studies on N-Substituted tranylcypromine derivatives lead to selective inhibitors of lysine specific demethylase 1 (LSD1) and potent inducers of leukemic cell differentiation. European Journal of Medicinal Chemistry. 144, 52-67 (2018).
- Ishii, T., et al. CETSA quantitatively verifies in vivo target engagement of novel RIPK1 inhibitors in various biospecimens. Scientific Report. 7, 13000 (2017).
- Maes, T. ORY-2001: An Epigenetic drug for the treatment of cognition defects in Alzheimer’s disease and other neurodegenerative disorders. Alzheimer’s & Dementia. 12 (7), P1192 (2017).

