केमोप्रोब-आधारित इम्युनोसेस का उपयोग करके KDM1A लक्ष्य सगाई का प्रत्यक्ष मापन
Summary
यहाँ, हम एक मानव या पशु सेल, ऊतक या रक्त के नमूने KDM1A inhibitors के साथ इलाज में KDM1A लक्ष्य सगाई को मापने के लिए एक प्रोटोकॉल प्रस्तुत करते हैं. प्रोटोकॉल मुक्त KDM1A एंजाइम और केमोप्रोब आधारित इम्यूनोसेस का उपयोग कर लक्ष्य व्यवसाय के प्रत्यक्ष परिमाणीकरण की chemoprobe टैगिंग कार्यरत हैं और पूर्व नैदानिक और नैदानिक अध्ययन में इस्तेमाल किया जा सकता है.
Abstract
लक्ष्य सगाई का आकलन, प्रोटीन के लिए डिजाइन किया गया था के साथ एक दवा की बातचीत के रूप में परिभाषित, दवा के विकास में या बुनियादी अनुसंधान परियोजनाओं में किसी भी यौगिक की जैविक गतिविधि की व्याख्या के लिए एक बुनियादी आवश्यकता है. epigenetics में, लक्ष्य सगाई सबसे अधिक बार प्रॉक्सी मार्करों के विश्लेषण के बजाय लक्ष्य के लिए परिसर के संघ को मापने के द्वारा मूल्यांकन किया है. डाउनस्ट्रीम जैविक readouts कि विश्लेषण किया गया है histone निशान मॉडुलन या जीन अभिव्यक्ति परिवर्तन शामिल हैं. KDM1A एक lysine demethylase है कि मोनो से मिथाइल समूहों को हटा- और dimethylated H3K4, जीन अभिव्यक्ति के silencing के साथ जुड़े एक संशोधन है. प्रॉक्सी मार्करों के मॉडुलन सेल प्रकार और जांच की कोशिकाओं के आनुवंशिक मेकअप के समारोह पर निर्भर है, जो व्याख्या और पार मामले तुलना काफी मुश्किल बना सकते हैं. इन समस्याओं को दरकिनार करने के लिए, एक बहुमुखी प्रोटोकॉल खुराक प्रभाव और प्रत्यक्ष KDM1A लक्ष्य सगाई की गतिशीलता का आकलन करने के लिए प्रस्तुत किया है. परख वर्णित एक KDM1A chemoprobe का उपयोग करने पर कब्जा करने और uninhibited एंजाइम मात्रा बनाता है, मोटे तौर पर आनुवंशिक संशोधन के लिए आवश्यकता के बिना कोशिकाओं या ऊतक के नमूने के लिए लागू किया जा सकता है, का पता लगाने का एक उत्कृष्ट खिड़की है, और बुनियादी अनुसंधान के लिए दोनों इस्तेमाल किया जा सकता है और नैदानिक नमूनों का विश्लेषण.
Introduction
Lysine विशिष्ट demethylase 1 (KDM1A)1 एक demethylase जीन प्रतिलेखन के नियंत्रण में शामिल है. यह प्रोटीन ऑन्कोलॉजी में एक उम्मीदवार औषधीय लक्ष्य2 के रूप में उभरा है; तीव्र माइलॉयड ल्यूकेमिया3 (एएमएल), मायलोडिप्लासिया सिंड्रोम (एमडीएस)4, मायलोफिब्रोसिस (एमएफ)5,6,छोटे सेल फेफड़ों के कैंसर (SCLC)7सहित; सिकल सेल रोग (एससीडी)8,9, और अल्जाइमर रोग (एडी), मल्टीपल स्केलेरोसिस (एमएस) सहित केंद्रीय तंत्रिका तंत्र रोगों में; और आक्रामकता में10.
नैदानिक विकास में केडीएम1ए बाधा यौगिकों में से अधिकांश साइक्लोप्रोपाइलामाइन डेरिवेटिव होते हैं और इसके फ्लाविन एडेनेन डेन्यूक्लिओटाइड (एफएडी) सहकारक11के लिए सहसंयोजक बंधन द्वारा प्रोटीन को रोकते हैं। KDM1A के निषेध जीन अभिव्यक्ति परिवर्तन लाती है, लेकिन इन परिवर्तनों के ऊतकों, सेल प्रकार, या रोग के मामलों में काफी भिन्नता है. KDM1A के निषेध भी histone निशान12परिवर्तन, अभी तक इन परिवर्तनों को आम तौर पर जीनोम में एक विशिष्ट साइट पर स्थानीय स्तर पर उत्पादित कर रहे हैं, और फिर से कर रहे हैं, उच्च ऊतक और सेल विशिष्ट.
प्रोटोकॉल सीधे जैविक नमूनों में KDM1A लक्ष्य सगाई को मापने के लिए विकसित किया गया था और cyclopropylamine व्युत्पन्न inhibitors के साथ उपयोग के लिए अनुकूलित किया गया है. परख ELISA प्रौद्योगिकी पर आधारित है और विश्लेषण करती है, समानांतर में, कुल और नि: शुल्क (यानी अवरोधकरनेक द्वारा असीम) KDM1A एक ठोस चरण परख में एक जैविक नमूने से एक देशी प्रोटीन निकालने में. एक पहला कदम के रूप में, जैविक नमूना biotinylated KDM1A चयनात्मक chemoprobe OG-88113,14, चयनात्मक KDM1A अवरोध करनेवाला ORY-1001 (iadademstat), नैदानिक में KDM1A के एक शक्तिशाली अवरोध करनेवाला की उपस्थिति में lysed है ओन्कोलॉजिकल बीमारी के उपचार के लिए विकास। कीमोप्रोब में 120 एनएम के केडीएम1ए के लिए एक आईसी 50 है और इसमें एक बायोटिनीलेड पॉलीथीन ग्लाइकोल (पीईजी)-टेल से जुड़ा एक एफएडी बाइंडिंग मोइटी शामिल है। chemoprobe विशेष रूप से मुक्त KDM1A करने के लिए बांधता है, लेकिन नमूने में अवरोध करनेवाला बाध्य KDM1A करने के लिए नहीं. chemoprobe बाइंडिंग के बाद, KDM1A नमूने में परिसरों युक्त मुक्त KDM1A निर्धारित करने के लिए streptavidin लेपित सतह के साथ microtiter प्लेटों पर कब्जा कर रहे हैं, या एक monoclonal विरोधी KDM1A कब्जा एंटीबॉडी के साथ लेपित प्लेटों पर कुल KDM1A निर्धारित करने के लिए. धोने के बाद, दोनों प्लेटों एक विरोधी KDM1A का पता लगाने एंटीबॉडी के साथ incubated रहे हैं, फिर से धोया, और एक माध्यमिक HRP-कंजुटेड गधा विरोधी Rabbit IgG एंटीबॉडी के साथ incubated एक lumincent सब्सट्रेट का उपयोग कर पता लगाने के लिए और परिमाणीकरण रिश्तेदार को मापने के द्वारा एक luminometer में प्रकाश इकाइयों (RLU) (चित्र 1).
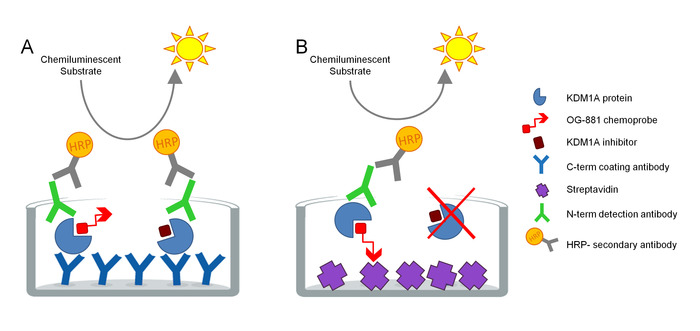
चित्र 1. ELISA एंजाइम से जुड़े chemoprobe इम्यूनोशोबनेंट परख KDM1A लक्ष्य सगाई के लिए स्कीमा: ए) कुल KDM1A का निर्धारण सैंडविच एलिसा और बी का उपयोग कर मुक्त KDM1A का निर्धारण chemoprobe ELISA का उपयोग कर. कृपया इस चित्र का एक बड़ा संस्करण देखने के लिए यहाँ क्लिक करें.
प्रत्येक परख की रैखिकता को सत्यापित करने के लिए एक मानक वक्र को एलिसा प्लेटदोनों में शामिल किया जाता है। प्रत्येक नमूने में KDM1A लक्ष्य सगाई का निर्धारण तो पूर्व खुराक या वाहन इलाज नमूना करने के लिए एक सापेक्ष मूल्य के रूप में गणना की है.
Protocol
Representative Results
Discussion
यहाँ प्रस्तुत प्रोटोकॉल सीधे एक उपन्यास KDM1A chemoprobe कब्जा आधारित एलिसा का उपयोग कर KDM1A लक्ष्य सगाई को मापने के लिए विकसित किया गया था. विधि सुसंस्कृत मानव सेल लाइनों और मानव, चूहे और माउस और baboon (PBMCs, फेफड़े, मस्त?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
इस अध्ययन Oryzon जीनोमिक्स द्वारा वित्त पोषण किया गया था. एस.ए., हॉफमैन-ला Roche, और आंशिक रूप से CIIP-20152001 और RETOS सहयोग कार्यक्रम RTC-2015-3332-1 द्वारा समर्थित है।
Materials
| 0,05% Trypsin-EDTA (1X) | Thermo Scientific | #25300-062 | |
| 10 X Protease Inhibitor Tablets | Roche | #11836153001 | |
| 96 deep well storage block | VWR | #734-1679 | |
| 96 well ELISA plates | Nunc | #436110 | |
| Adhesive black Film | Perkin Elmer | #6050173 | |
| Adhesive transparent Film | VWR | #60941-062 | |
| Biotinylated KDM1A probe OG-881 | Oryzon Genomics S.A. | NA | |
| Bovine Serum Albumin | Sigma | # 3117057001 | |
| Bovine Serum Albumin Standard | Thermo Scientific | #23208) | |
| Bradford Protein Assay | BioRad | #500-0001 | |
| Cell lysis buffer 10X | Cell Signaling | #9803 | |
| Centrifuge for 96- well plates | Hettich | Rotina 420R | |
| Flask | Thermo Scientific | #156499 | |
| Full length, enzymatically active human Recombinant LSD1 / KDM1A | Active Motif | #31426 | |
| Graphpad Prism 5 Project | GraphPad Software | NA | |
| Luminol-Enhacer and Peroxide Solution (Chemiluminescent Substrate) | Thermo Scientific | #37074 | |
| Micro Centrifuge | Eppendorf | 5415 R | |
| Microplate reader Infinite 200-Tecan | Tecan | Infinite 200 | |
| Mouse monoclonal capture antibody Anti-KDM1A (N-terminal epitope) | Abcam | #ab53269 | |
| Needle G18 gauge blunt | BD | #303129 | |
| ORY-1001 (iadademstat) | Oryzon Genomics S.A. | NA | |
| PBMC separation tubes 10 ml | Greiner bio-one | #163288 | |
| PBMC separation tubes 50 ml | Greiner bio-one | #227288 | |
| PBS 1x | Sigma | #D8537 | |
| Plate shaker | Heidolph Instruments | Rotamax 120 | |
| Polysorbate 20 | Sigma | #P7949 | |
| Rabbit monoclonal detection antibody Anti-KDM1A (C-terminal epitope) | Cell Signaling | #672184BF-100 | |
| Secondary antibody Peroxidase-conjugated Donkey Anti-rabbit IgG | Thermo Scientific | #31458 | |
| Spectrophotometer cuvette 1.5 | Deltalab | #302100 | |
| Spectrophotometer for cuvette | GE Healthcare | GeneQuant 1300 | |
| Streptavidin | Promega | #Z704A | |
| Syringe | BD | #303172 | |
| Type 1 ultrapure water | Millipore | Milli-Q Advantage A10 | |
| Ultrasonic cleaner | VWR | USC200T |
References
- Shi, Y. Histone demethylation mediated by the nuclear amine oxidase homolog LSD1. Cell. 119 (7), 941-953 (2004).
- Maiques-Diaz, A., Somervaille, T. C. LSD1: biologic roles and therapeutic targeting. Epigenomics. 8 (8), 1103-1116 (2016).
- Maes, T. ORY-1001, a Potent and Selective Covalent KDM1A Inhibitor, for the Treatment of Acute Leukemia. Cancer Cell. 33 (3), 495-511 (2018).
- Sugino, N. A novel LSD1 inhibitor NCD38 ameliorates MDS-related leukemia with complex karyotype by attenuating leukemia programs via activating super-enhancers. Leukemia. 31 (11), 2303-2314 (2017).
- Kleppe, M., Shank, K., Efthymia, P., Riehnhoff, H., Levine, R. L. Lysine-Specific Histone Demethylase, LSD1, (KDM1A) As a Novel Therapeutic Target in Myeloproliferative Neoplasms. Blood. 126, 601 (2015).
- Jutzi, J. S., et al. LSD1 Inhibition Prolongs Survival in Mouse Models of MPN by Selectively Targeting the Disease Clone. HemaSphere. 2 (3), 54 (2018).
- Mohammad, H. P. DNA Hypomethylation Signature Predicts Antitumor Activity of LSD1 Inhibitors in SCLC. Cancer Cell. 28 (1), 57-69 (2015).
- Rivers, A., et al. RN-1, a potent and selective lysine-specific demethylase 1 inhibitor, increases γ-globin expression, F reticulocytes, and F cells in a sickle cell disease mouse model. Experimental Hematology. 43 (7), 546-553 (2015).
- Rivers, A. Oral administration of the LSD1 inhibitor ORY-3001 increases fetal hemoglobin in sickle cell mice and baboons. Experimental Hematology. 67, 60-64 (2018).
- Buesa, C., et al. The dual LSD1/MAO-B inhibitor ORY-2001 prevents the development of the memory deficit in samp8 mice through induction of neuronal plasticity and reduction of neuroinflammation. Alzheimer’s & Dementia. 11 (7), P905 (2015).
- Schmidt, D. M., McCafferty, D. G. Trans-2-Phenylcyclopropylamine is a mechanism-based inactivator of the histone demethylase LSD1. Biochemistry. 46 (14), 4408-4416 (2007).
- Forneris, F., Binda, C., Vanoni, M. A., Battaglioli, E., Mattevi, A. Human histone demethylase LSD1 reads the histone code. Journal of Biological Chemistry. 280 (50), 41360-41365 (2005).
- Gonz#225;lez, E. C., Maes, T., Crusat, C. M., Mu#241;oz, A. O. Oryzon Genomics, Methods to determine kdm1a target engagement and chemoprobes useful therefor. , (2016).
- Mascaró, C., Ortega, A., Carceller, E., Rruiz Rodriguez, R., Cicero, F., Lunardi, S., Yu, L., Hilbert, M., Maes, T. Chemoprobe-based assays of histone lysine demethylase 1A target occupation enable in vivo pharmacokinetics and -dynamics studies of KDM1A inhibitors. Journal of Biological Chemistry. , (2019).
- Rodriguez-Suarez, R. Development of Homogeneous Nonradioactive Methyltransferase and Demethylase Assays Targeting Histone H3 Lysine 4. Journal of Biomolecular Screening. 17 (1), 49-58 (2011).
- Lynch, J. T., Cockerill, M. J., Hitchin, J. R., Wiseman, D. H., Somervaille, T. C. CD86 expression as a surrogate cellular biomarker for pharmacological inhibition of the histone demethylase lysine-specific demethylase 1. Analytical Biochemistry. 442 (1), 104-106 (2013).
- Schulz-Fincke, J. Structure-activity studies on N-Substituted tranylcypromine derivatives lead to selective inhibitors of lysine specific demethylase 1 (LSD1) and potent inducers of leukemic cell differentiation. European Journal of Medicinal Chemistry. 144, 52-67 (2018).
- Ishii, T., et al. CETSA quantitatively verifies in vivo target engagement of novel RIPK1 inhibitors in various biospecimens. Scientific Report. 7, 13000 (2017).
- Maes, T. ORY-2001: An Epigenetic drug for the treatment of cognition defects in Alzheimer’s disease and other neurodegenerative disorders. Alzheimer’s & Dementia. 12 (7), P1192 (2017).

