ケモプローブベースの免疫アッセイを用いてKDM1A標的エンゲージメントを直接測定
Summary
ここでは、KDM1A阻害剤で処理したヒトまたは動物細胞、組織または血液試料におけるKDM1A標的関与を測定するプロトコルを提示する。このプロトコルは、自由なKDM1A酵素の化学療法タグ付けと、化学プローブベースの免疫アッセイを用いた標的職業の直接定量を採用し、前臨床および臨床研究で使用することができます。
Abstract
標的エンゲージメントの評価は、それが設計されたタンパク質との薬物の相互作用として定義され、医薬品開発または基礎研究プロジェクトにおける任意の化合物の生物学的活性の解釈のための基本的な要件である。エピジェネティクスでは、ターゲットエンゲージメントは、化合物の標的との結合を測定するのではなく、プロキシマーカーの分析によって最も頻繁に評価されます。分析された下流の生物学的読み出しには、ヒストンマーク変調または遺伝子発現の変化が含まれる。KDM1Aは、モノラルおよびジメチル化H3K4からメチル基を除去するリジンデメチラーゼであり、遺伝子発現のサイレンシングに関連する修飾である。プロキシマーカーの変調は、調査された細胞の遺伝的構成の細胞の種類と機能に依存し、解釈と大文字と小文字の比較を非常に困難にすることができます。これらの問題を回避するために、直接KDM1Aターゲットエンゲージメントの線量効果およびダイナミクスを評価する汎用性の高いプロトコルが提示される。記載されたアッセイは、KDM1Aケモプローブを使用して、非抑制酵素を捕捉し、定量化し、遺伝子改変を必要とせずに細胞や組織サンプルに広く適用することができ、検出の優れた窓を有し、基礎研究の両方に使用することができます臨床サンプルの分析。
Introduction
リジン特異的デメチラーゼ1(KDM1A)1は、遺伝子転写の制御に関与するデメチラーゼである。このタンパク質は、腫瘍学における候補薬理学的標的2として出現した。急性骨髄性白血病3(AML)、骨髄異形成症候群(MDS)4、骨髄線維症(MF)5、6、小細胞肺癌(SCLC)7を含む; 鎌状赤血球病(SCD)8、9、およびアルツハイマー病(AD)、多発性硬化症(MS)を含む中枢神経系疾患において。そして侵略10で.
臨床開発におけるKDM1A阻害化合物のほとんどは、シクロプロピラミン誘導体であり、そのフラビンアデニンジヌクレオチド(FAD)共因子11に共価結合することによってタンパク質を阻害する。KDM1Aの阻害は遺伝子発現変化を誘発するが、これらの変化は組織、細胞型、または疾患の場合によって大きく異なる。KDM1Aの阻害はまたヒストンマーク12を変化させ、しかもこれらの変化は一般にゲノム内の特定の部位で局所的に産生され、再び、高度な組織および細胞特異的である。
このプロトコルは、生体試料におけるKDM1A標的関与を直接測定するために開発され、シクロプロピラミン由来阻害剤との使用に最適化されています。アッセイはELISA技術に基づいており、相物由来アッセイ中の生体タンパク質抽出物中のKDM1Aを並行して、トータルおよびフリー(阻害剤によって結合しない)を分析する。第一段階として、生体試料は、ビオチン化KDM1A選択的化学プローブOG-88113,14の存在下で、臨床におけるKDM1Aの強力な阻害剤である選択的KDM1A阻害剤ORY-1001(iadademstat)に由来する。オンコジカル疾患の治療のための開発。化学プローブは120 nMのKDM1AのためのIC50を有し、生物化ポリエチレングリコール(PEG)-尾にリンクされたFAD結合部分を含んでいる。化学プローブは、自由なKDM1Aに排他的に結合しますが、サンプル中の阻害剤結合KDM1Aには結合しません。化学プローブ結合後、試料中の複合体を含むKDM1Aは、ストレプトアビジンコーティング面を有するマイクロチタプレート上で捕捉され、遊値KDM1Aを決定するか、またはモノクローナル抗KDM1A捕捉抗体で被覆されたプレート上で、全KDM1Aを決定する。洗浄後、両方のプレートを抗KDM1A検出抗体でインキュベートし、再度洗浄し、二次HRP結合ロバ抗ウサギIgG抗体でインキュベートし、相対測定による発光基板と定量を用いて検出した。照明計の光単位(RLU)(図1)。
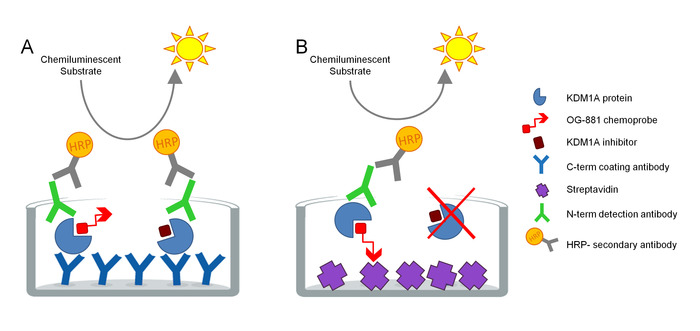
図 1.ELISA酵素のスキーマは、KDM1A標的関与に対する化学プローブ免疫吸収性アッセイを連結した:A)サンドイッチELISAおよびBを用いて全KDM1Aの決定)ケモプローブELISAを用いて自由KDM1Aの決定を行った。この図のより大きなバージョンを表示するには、ここをクリックしてください。
標準曲線は、各アッセイの直線性を検証するために、両方のELISAプレートに含まれています。各サンプルにおけるKDM1Aターゲットエンゲージメントの決定は、次いで、前用量または車両処理サンプルに対する相対値として計算される。
Protocol
Representative Results
Discussion
ここで提示されたプロトコルは、新しいKDM1Aケモプローブ捕捉ベースのELISAを用いてKDM1Aターゲットエンゲージメントを直接測定するために開発された。この方法は、ヒト、ラット、マウスおよびヒヒ(PBMC、肺、脳、皮膚、腫瘍を含む)からの培養ヒト細胞株およびex vivoサンプルで検証されたが、KDM1A抗体標的エピトープおよび触媒を有する他の種に容易に適用することができる。中央は保存さ?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
本研究はオリゾンゲノミクスが出資した。S.A.、ホフマン・ラ・ロシュ、CIIP-20152001およびRETOSコラボレーションプログラムRTC-2015-3332-1によって部分的にサポートされています。
Materials
| 0,05% Trypsin-EDTA (1X) | Thermo Scientific | #25300-062 | |
| 10 X Protease Inhibitor Tablets | Roche | #11836153001 | |
| 96 deep well storage block | VWR | #734-1679 | |
| 96 well ELISA plates | Nunc | #436110 | |
| Adhesive black Film | Perkin Elmer | #6050173 | |
| Adhesive transparent Film | VWR | #60941-062 | |
| Biotinylated KDM1A probe OG-881 | Oryzon Genomics S.A. | NA | |
| Bovine Serum Albumin | Sigma | # 3117057001 | |
| Bovine Serum Albumin Standard | Thermo Scientific | #23208) | |
| Bradford Protein Assay | BioRad | #500-0001 | |
| Cell lysis buffer 10X | Cell Signaling | #9803 | |
| Centrifuge for 96- well plates | Hettich | Rotina 420R | |
| Flask | Thermo Scientific | #156499 | |
| Full length, enzymatically active human Recombinant LSD1 / KDM1A | Active Motif | #31426 | |
| Graphpad Prism 5 Project | GraphPad Software | NA | |
| Luminol-Enhacer and Peroxide Solution (Chemiluminescent Substrate) | Thermo Scientific | #37074 | |
| Micro Centrifuge | Eppendorf | 5415 R | |
| Microplate reader Infinite 200-Tecan | Tecan | Infinite 200 | |
| Mouse monoclonal capture antibody Anti-KDM1A (N-terminal epitope) | Abcam | #ab53269 | |
| Needle G18 gauge blunt | BD | #303129 | |
| ORY-1001 (iadademstat) | Oryzon Genomics S.A. | NA | |
| PBMC separation tubes 10 ml | Greiner bio-one | #163288 | |
| PBMC separation tubes 50 ml | Greiner bio-one | #227288 | |
| PBS 1x | Sigma | #D8537 | |
| Plate shaker | Heidolph Instruments | Rotamax 120 | |
| Polysorbate 20 | Sigma | #P7949 | |
| Rabbit monoclonal detection antibody Anti-KDM1A (C-terminal epitope) | Cell Signaling | #672184BF-100 | |
| Secondary antibody Peroxidase-conjugated Donkey Anti-rabbit IgG | Thermo Scientific | #31458 | |
| Spectrophotometer cuvette 1.5 | Deltalab | #302100 | |
| Spectrophotometer for cuvette | GE Healthcare | GeneQuant 1300 | |
| Streptavidin | Promega | #Z704A | |
| Syringe | BD | #303172 | |
| Type 1 ultrapure water | Millipore | Milli-Q Advantage A10 | |
| Ultrasonic cleaner | VWR | USC200T |
References
- Shi, Y. Histone demethylation mediated by the nuclear amine oxidase homolog LSD1. Cell. 119 (7), 941-953 (2004).
- Maiques-Diaz, A., Somervaille, T. C. LSD1: biologic roles and therapeutic targeting. Epigenomics. 8 (8), 1103-1116 (2016).
- Maes, T. ORY-1001, a Potent and Selective Covalent KDM1A Inhibitor, for the Treatment of Acute Leukemia. Cancer Cell. 33 (3), 495-511 (2018).
- Sugino, N. A novel LSD1 inhibitor NCD38 ameliorates MDS-related leukemia with complex karyotype by attenuating leukemia programs via activating super-enhancers. Leukemia. 31 (11), 2303-2314 (2017).
- Kleppe, M., Shank, K., Efthymia, P., Riehnhoff, H., Levine, R. L. Lysine-Specific Histone Demethylase, LSD1, (KDM1A) As a Novel Therapeutic Target in Myeloproliferative Neoplasms. Blood. 126, 601 (2015).
- Jutzi, J. S., et al. LSD1 Inhibition Prolongs Survival in Mouse Models of MPN by Selectively Targeting the Disease Clone. HemaSphere. 2 (3), 54 (2018).
- Mohammad, H. P. DNA Hypomethylation Signature Predicts Antitumor Activity of LSD1 Inhibitors in SCLC. Cancer Cell. 28 (1), 57-69 (2015).
- Rivers, A., et al. RN-1, a potent and selective lysine-specific demethylase 1 inhibitor, increases γ-globin expression, F reticulocytes, and F cells in a sickle cell disease mouse model. Experimental Hematology. 43 (7), 546-553 (2015).
- Rivers, A. Oral administration of the LSD1 inhibitor ORY-3001 increases fetal hemoglobin in sickle cell mice and baboons. Experimental Hematology. 67, 60-64 (2018).
- Buesa, C., et al. The dual LSD1/MAO-B inhibitor ORY-2001 prevents the development of the memory deficit in samp8 mice through induction of neuronal plasticity and reduction of neuroinflammation. Alzheimer’s & Dementia. 11 (7), P905 (2015).
- Schmidt, D. M., McCafferty, D. G. Trans-2-Phenylcyclopropylamine is a mechanism-based inactivator of the histone demethylase LSD1. Biochemistry. 46 (14), 4408-4416 (2007).
- Forneris, F., Binda, C., Vanoni, M. A., Battaglioli, E., Mattevi, A. Human histone demethylase LSD1 reads the histone code. Journal of Biological Chemistry. 280 (50), 41360-41365 (2005).
- Gonz#225;lez, E. C., Maes, T., Crusat, C. M., Mu#241;oz, A. O. Oryzon Genomics, Methods to determine kdm1a target engagement and chemoprobes useful therefor. , (2016).
- Mascaró, C., Ortega, A., Carceller, E., Rruiz Rodriguez, R., Cicero, F., Lunardi, S., Yu, L., Hilbert, M., Maes, T. Chemoprobe-based assays of histone lysine demethylase 1A target occupation enable in vivo pharmacokinetics and -dynamics studies of KDM1A inhibitors. Journal of Biological Chemistry. , (2019).
- Rodriguez-Suarez, R. Development of Homogeneous Nonradioactive Methyltransferase and Demethylase Assays Targeting Histone H3 Lysine 4. Journal of Biomolecular Screening. 17 (1), 49-58 (2011).
- Lynch, J. T., Cockerill, M. J., Hitchin, J. R., Wiseman, D. H., Somervaille, T. C. CD86 expression as a surrogate cellular biomarker for pharmacological inhibition of the histone demethylase lysine-specific demethylase 1. Analytical Biochemistry. 442 (1), 104-106 (2013).
- Schulz-Fincke, J. Structure-activity studies on N-Substituted tranylcypromine derivatives lead to selective inhibitors of lysine specific demethylase 1 (LSD1) and potent inducers of leukemic cell differentiation. European Journal of Medicinal Chemistry. 144, 52-67 (2018).
- Ishii, T., et al. CETSA quantitatively verifies in vivo target engagement of novel RIPK1 inhibitors in various biospecimens. Scientific Report. 7, 13000 (2017).
- Maes, T. ORY-2001: An Epigenetic drug for the treatment of cognition defects in Alzheimer’s disease and other neurodegenerative disorders. Alzheimer’s & Dementia. 12 (7), P1192 (2017).

