Medición directa del compromiso objetivo de KDM1A mediante inmunoensayos basados en chemoprobe
Summary
Aquí, presentamos un protocolo para medir el compromiso objetivo de KDM1A en una célula humana o animal, muestras de tejido o sangre tratadas con inhibidores de KDM1A. El protocolo emplea el etiquetado quimioprobe de la enzima KDM1A libre y la cuantificación directa de la ocupación objetivo mediante inmunoensayos basados en quimiosondas y se puede utilizar en estudios preclínicos y clínicos.
Abstract
La evaluación de la participación objetivo, definida como la interacción de un medicamento con la proteína para la que fue diseñado, es un requisito básico para la interpretación de la actividad biológica de cualquier compuesto en el desarrollo de fármacos o en proyectos de investigación básica. En la epigenética, la participación objetivo se evalúa con mayor frecuencia mediante el análisis de marcadores proxy en lugar de medir la unión del compuesto con el objetivo. Las lecturas biológicas aguas abajo que se han analizado incluyen la modulación de la marca de histona o los cambios en la expresión génica. KDM1A es una lisina demetilasa que elimina los grupos metilo de H3K4 mono y dimetilado, una modificación asociada con el silenciamiento de la expresión génica. La modulación de los marcadores proxy depende del tipo de célula y la función de la composición genética de las células investigadas, lo que puede dificultar la interpretación y la comparación entre mayúsculas y minúsculas. Para evitar estos problemas, se presenta un protocolo versátil para evaluar los efectos de la dosis y la dinámica de la participación directa de la meta de KDM1A. El ensayo descrito hace uso de una quimiosonda KDM1A para capturar y cuantificar enzimas desinhibidas, se puede aplicar ampliamente a células o muestras de tejido sin necesidad de modificación genética, tiene una excelente ventana de detección, y se puede utilizar tanto para la investigación básica y análisis de muestras clínicas.
Introduction
Lisina específica demetilasa 1 (KDM1A)1 es una demetilasa implicada en el control de la transcripción génica. Esta proteína ha surgido como un objetivo farmacológico candidato2 en oncología; incluyendo Leucemia mieloide aguda3 (LMA), Síndrome de mielodisplasia (MdS)4, Mielofibrosis (MF)5,6, Cáncer de pulmón de células pequeñas (SCLC)7; en la enfermedad de células falciformes (SCD)8,9, y en enfermedades del sistema nervioso central incluyendo la enfermedad de Alzheimer (AD), Esclerosis Múltiple (MS); y en agresión10.
La mayoría de los compuestos inhibidores de KDM1A en el desarrollo clínico son derivados de la ciclopropilina e inhiben la proteína mediante la unión covalente a su conucleótido de adenina de flavina (FAD) cofactor11. La inhibición de KDM1A induce cambios en la expresión génica, pero estos cambios varían enormemente entre tejidos, tipos de células o casos de enfermedad. La inhibición de KDM1A también cambia las marcas de histona12,sin embargo, estos cambios generalmente se producen localmente en un sitio específico en el genoma, y son de nuevo, altamente tejido y específico de las células.
El protocolo fue desarrollado para medir directamente la participación objetivo de KDM1A en muestras biológicas y ha sido optimizado para el uso con inhibidores derivados de la ciclopropilina. El ensayo se basa en la tecnología ELISA y analiza, en paralelo, Total y Libre (es decir, no unido por inhibidor) KDM1A en un extracto de proteína nativa de una muestra biológica en un ensayo de fase sólida. Como primer paso, la muestra biológica se lysed en presencia de la quimiosonda selectiva biotinilada KDM1A OG-88113,14, derivada del inhibidor selectivo KDM1A ORY-1001 (iadademstat), un potente inhibidor de KDM1A en clínica desarrollo para el tratamiento de enfermedades oncológicas. La quimiosonda tiene un IC50 para KDM1A de 120 nM e incluye una mitad de unión FAD vinculada a una cola de polietileno glicol biotinilado (PEG). La quimiosonda se une exclusivamente al KDM1A libre, pero no al KDM1A ligado a inhibidores en la muestra. Después de la unión de quimiosonda, el KDM1A que contiene complejos en la muestra se captura nado en placas microtíteres con superficie recubierta de estreptavidina para determinar KDM1A libre, o en placas recubiertas con un anticuerpo de captura monoclonal anti-KDM1A para determinar el Total de KDM1A. Después del lavado, ambas placas se incuban con un anticuerpo de detección anti-KDM1A, se lavan de nuevo, y se incuban con un anticuerpo secundario anticonejo anticonejo conjugado con conjugado con HRP para su detección utilizando un sustrato luminiscente y la cuantificación midiendo unidades de luz (RLU) en un luminómetro (Figura1).
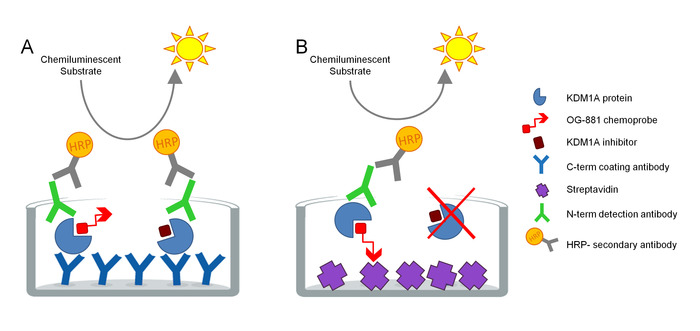
Figura 1. Esquema de elsay de inmunoabsorbente de quimiosonda ligada a enzimas ELISA para el compromiso objetivo KDM1A: A) Determinación del Total de KDM1A utilizando el sándwich ELISA y B) Determinación de KDM1A libre utilizando quimiosonda ELISA. Haga clic aquí para ver una versión más grande de esta figura.
Se incluye una curva estándar en ambas placas ELISA para verificar la linealidad de cada ensayo. La determinación de la participación objetivo de KDM1A en cada muestra se calcula entonces como un valor relativo a la muestra predosis o tratada por el vehículo.
Protocol
Representative Results
Discussion
El protocolo presentado aquí fue desarrollado para medir directamente el compromiso objetivo de KDM1A utilizando una nueva captura de quimiosondas KDM1A basada en ELISA. El método ha sido validado en líneas celulares humanas cultivadas y muestras ex vivo de humanos, ratas y ratones y babuinos (incluyendo PPBCM, pulmón, cerebro, piel, tumores), pero se puede aplicar fácilmente a otras especies en las que los epítopos objetivo de anticuerpos KDM1A y catalíticos centro se conservan. Como OG-881 es una quimiosonda bas…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Este estudio fue financiado por Oryzon Genomics. S.A., Hoffman-La Roche, y parcialmente apoyado por el CIIP-20152001 y el programa de colaboración RETOS RTC-2015-3332-1.
Materials
| 0,05% Trypsin-EDTA (1X) | Thermo Scientific | #25300-062 | |
| 10 X Protease Inhibitor Tablets | Roche | #11836153001 | |
| 96 deep well storage block | VWR | #734-1679 | |
| 96 well ELISA plates | Nunc | #436110 | |
| Adhesive black Film | Perkin Elmer | #6050173 | |
| Adhesive transparent Film | VWR | #60941-062 | |
| Biotinylated KDM1A probe OG-881 | Oryzon Genomics S.A. | NA | |
| Bovine Serum Albumin | Sigma | # 3117057001 | |
| Bovine Serum Albumin Standard | Thermo Scientific | #23208) | |
| Bradford Protein Assay | BioRad | #500-0001 | |
| Cell lysis buffer 10X | Cell Signaling | #9803 | |
| Centrifuge for 96- well plates | Hettich | Rotina 420R | |
| Flask | Thermo Scientific | #156499 | |
| Full length, enzymatically active human Recombinant LSD1 / KDM1A | Active Motif | #31426 | |
| Graphpad Prism 5 Project | GraphPad Software | NA | |
| Luminol-Enhacer and Peroxide Solution (Chemiluminescent Substrate) | Thermo Scientific | #37074 | |
| Micro Centrifuge | Eppendorf | 5415 R | |
| Microplate reader Infinite 200-Tecan | Tecan | Infinite 200 | |
| Mouse monoclonal capture antibody Anti-KDM1A (N-terminal epitope) | Abcam | #ab53269 | |
| Needle G18 gauge blunt | BD | #303129 | |
| ORY-1001 (iadademstat) | Oryzon Genomics S.A. | NA | |
| PBMC separation tubes 10 ml | Greiner bio-one | #163288 | |
| PBMC separation tubes 50 ml | Greiner bio-one | #227288 | |
| PBS 1x | Sigma | #D8537 | |
| Plate shaker | Heidolph Instruments | Rotamax 120 | |
| Polysorbate 20 | Sigma | #P7949 | |
| Rabbit monoclonal detection antibody Anti-KDM1A (C-terminal epitope) | Cell Signaling | #672184BF-100 | |
| Secondary antibody Peroxidase-conjugated Donkey Anti-rabbit IgG | Thermo Scientific | #31458 | |
| Spectrophotometer cuvette 1.5 | Deltalab | #302100 | |
| Spectrophotometer for cuvette | GE Healthcare | GeneQuant 1300 | |
| Streptavidin | Promega | #Z704A | |
| Syringe | BD | #303172 | |
| Type 1 ultrapure water | Millipore | Milli-Q Advantage A10 | |
| Ultrasonic cleaner | VWR | USC200T |
References
- Shi, Y. Histone demethylation mediated by the nuclear amine oxidase homolog LSD1. Cell. 119 (7), 941-953 (2004).
- Maiques-Diaz, A., Somervaille, T. C. LSD1: biologic roles and therapeutic targeting. Epigenomics. 8 (8), 1103-1116 (2016).
- Maes, T. ORY-1001, a Potent and Selective Covalent KDM1A Inhibitor, for the Treatment of Acute Leukemia. Cancer Cell. 33 (3), 495-511 (2018).
- Sugino, N. A novel LSD1 inhibitor NCD38 ameliorates MDS-related leukemia with complex karyotype by attenuating leukemia programs via activating super-enhancers. Leukemia. 31 (11), 2303-2314 (2017).
- Kleppe, M., Shank, K., Efthymia, P., Riehnhoff, H., Levine, R. L. Lysine-Specific Histone Demethylase, LSD1, (KDM1A) As a Novel Therapeutic Target in Myeloproliferative Neoplasms. Blood. 126, 601 (2015).
- Jutzi, J. S., et al. LSD1 Inhibition Prolongs Survival in Mouse Models of MPN by Selectively Targeting the Disease Clone. HemaSphere. 2 (3), 54 (2018).
- Mohammad, H. P. DNA Hypomethylation Signature Predicts Antitumor Activity of LSD1 Inhibitors in SCLC. Cancer Cell. 28 (1), 57-69 (2015).
- Rivers, A., et al. RN-1, a potent and selective lysine-specific demethylase 1 inhibitor, increases γ-globin expression, F reticulocytes, and F cells in a sickle cell disease mouse model. Experimental Hematology. 43 (7), 546-553 (2015).
- Rivers, A. Oral administration of the LSD1 inhibitor ORY-3001 increases fetal hemoglobin in sickle cell mice and baboons. Experimental Hematology. 67, 60-64 (2018).
- Buesa, C., et al. The dual LSD1/MAO-B inhibitor ORY-2001 prevents the development of the memory deficit in samp8 mice through induction of neuronal plasticity and reduction of neuroinflammation. Alzheimer’s & Dementia. 11 (7), P905 (2015).
- Schmidt, D. M., McCafferty, D. G. Trans-2-Phenylcyclopropylamine is a mechanism-based inactivator of the histone demethylase LSD1. Biochemistry. 46 (14), 4408-4416 (2007).
- Forneris, F., Binda, C., Vanoni, M. A., Battaglioli, E., Mattevi, A. Human histone demethylase LSD1 reads the histone code. Journal of Biological Chemistry. 280 (50), 41360-41365 (2005).
- Gonz#225;lez, E. C., Maes, T., Crusat, C. M., Mu#241;oz, A. O. Oryzon Genomics, Methods to determine kdm1a target engagement and chemoprobes useful therefor. , (2016).
- Mascaró, C., Ortega, A., Carceller, E., Rruiz Rodriguez, R., Cicero, F., Lunardi, S., Yu, L., Hilbert, M., Maes, T. Chemoprobe-based assays of histone lysine demethylase 1A target occupation enable in vivo pharmacokinetics and -dynamics studies of KDM1A inhibitors. Journal of Biological Chemistry. , (2019).
- Rodriguez-Suarez, R. Development of Homogeneous Nonradioactive Methyltransferase and Demethylase Assays Targeting Histone H3 Lysine 4. Journal of Biomolecular Screening. 17 (1), 49-58 (2011).
- Lynch, J. T., Cockerill, M. J., Hitchin, J. R., Wiseman, D. H., Somervaille, T. C. CD86 expression as a surrogate cellular biomarker for pharmacological inhibition of the histone demethylase lysine-specific demethylase 1. Analytical Biochemistry. 442 (1), 104-106 (2013).
- Schulz-Fincke, J. Structure-activity studies on N-Substituted tranylcypromine derivatives lead to selective inhibitors of lysine specific demethylase 1 (LSD1) and potent inducers of leukemic cell differentiation. European Journal of Medicinal Chemistry. 144, 52-67 (2018).
- Ishii, T., et al. CETSA quantitatively verifies in vivo target engagement of novel RIPK1 inhibitors in various biospecimens. Scientific Report. 7, 13000 (2017).
- Maes, T. ORY-2001: An Epigenetic drug for the treatment of cognition defects in Alzheimer’s disease and other neurodegenerative disorders. Alzheimer’s & Dementia. 12 (7), P1192 (2017).

