建模与嗅觉药物传送的模拟与鼻吸入气雾剂药品的被动和主动控制
Summary
This manuscript reviews the modeling and simulations of different protocols to deliver medications to the olfactory region in image-based nasal airway models. Multiple software modules are used to develop the anatomically accurate nose model, generate computational mesh, simulate nasal airflows, and predict particle deposition at the olfactory region.
Abstract
有在神经学病症的治疗中直接鼻子到大脑的药物输送的许多优点。然而,它的应用是由极低递送效率(<1%),以直接连接大脑嗅粘膜的限制。它是开发新颖的技术,以更有效地对嗅觉区域递送神经药物是至关重要的。本研究的目的是建立一个数值平台来模拟和改善鼻内嗅觉药物传送。一个联动图像CFD方法,提出了原料合成基于图像的模式发展,以质量啮合,流体模拟,和磁粉跟踪。用这种方法,三个鼻内递送协议性能进行了数值评估和比较。呼吸机动,磁铁布局,磁场强度,药物释放的位置,并在嗅觉剂量粒径的影响进行了数值研究。
从Simulations,我们发现,在临床显著嗅觉剂量(高达45%),使用磁铁布局和选择性的药物释放的组合是可行的。用量的64倍更高的交付与磁致指导的情况相比,没有它的情况进行了预测。但是,经鼻吸入气雾剂到嗅觉区域的精确导向,由于磁电泳的不稳定性质,以及嗅觉剂量患者 – ,设备,平台,和粒子有关的因素的高灵敏度仍然具有挑战性。
Introduction
药物输送到嗅觉区可以绕过血-脑屏障,并直接进入大脑,导致药物1,2-的有效摄取和快速行动发作。然而,传统的鼻腔的设备,如鼻泵和喷雾剂经由鼻途径3,4-递送极低剂量到嗅觉区域(<1%)。它主要是由于它是由狭窄的,回旋通路( 图1)的人的鼻子的复杂的结构。嗅觉区域位于上鼻道,其中仅吸入空气的一小部分可以达到5,6的上方。此外,传统的吸入装置依靠空气动力治疗剂输送到所述目标区7。有超过粒子释放后的运动没有进一步的控制。因此,这些粒子的运输和沉积主要是取决于它们的初始速度和释放的位置。应有向旋绕鼻通道以及缺乏颗粒控制的,大多数药物颗粒被截留在前壁鼻子和不能到达嗅觉区域8。
虽然有鼻设备的选择,对于那些嗅觉针对性交货很少被报道7,9专门设计的。一个例外是Hoekman和何10谁开发的嗅觉优先输送装置以及具备更高的大鼠皮层对血药水平,而不是用鼻子下降。然而,在大鼠缩放沉积的结果对人类并不简单,考虑到这两个品种11之间的广袤的解剖和生理上的差异。使用嗅觉交付标准的鼻设备的改编版本时存在着诸多限制。一个主要缺陷是,只有药物的一个非常小的部分可被输送到嗅粘膜,通过该药物可能进入脑。数值模拟预测,鼻内施用纳米颗粒小于0.5%所用的嗅觉区3,5-沉积。淀积速率是即使对微米颗粒12低(0.007%)。为了使鼻子到脑递送临床可行,嗅觉沉积速率,必须显著改善。
存在改善嗅觉交付几种可能的方法。一种方法是通过Kleinstreuer 等人 13提出作为在一个区域上沉积的颗粒主要是由在入口一个特定区域中的智能吸入器的想法,也可以通过在入口处从某些区域仅释放他们提供颗粒到目标部位。智能递送技术已经显示出,以产生一个更有效的肺递送比常规方法。13,14这是假设,这个智能输送想法也可在鼻内药物递送应用到我的mProve剂量到嗅粘膜。通过释放颗粒进入在鼻孔开口和从鼻腔内的不同深度位置不同,改进的嗅觉递送效率和前鼻降低药物浪费是可能的。
另一个可能的方法是积极控制使用各种字段的力,如电场或磁场力的鼻腔内的颗粒运动。带电粒子的电控制已被建议用于靶向药物递送到人的鼻子和肺部15-17。习等人 18数值测试的带电粒子的电指导的性能和预测显著改善嗅觉的剂量。同样地,用适当的磁场铁磁药物颗粒的指导也有到目标粒子嗅粘膜的潜力。吸入剂的行为,如果铁磁性,可以通过适当的施加磁力改变<suP> 19。达梅斯等人 20表明,它是实际的目标铁磁粒子,以在小鼠肺特定区域。通过封装的治疗剂的超顺磁性氧化铁纳米颗粒,在小鼠中的一个肺沉积强磁场的影响下被显著增加相比,其他肺20。
颗粒假设是球形的,并从150纳米至30微米的直径范围。控制方程为21:
(1) 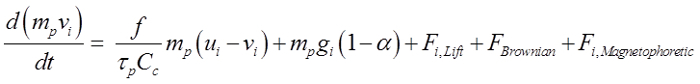
上述公式描述如果放在磁场中受阻力,重力,Saffman升力22纳米粒子布朗力,磁致力支配的粒子的运动。此处,V i是粒子速度u i是流速,τp是粒子响应时间,C c是坎宁安修正系数,α是空气/颗粒密度比。为了有效地引导鼻内施用的药物到嗅觉区域,有必要对所施加的磁泳力,以克服这两种颗粒的惯性和重力。在这项研究中,20%的磁赤铁矿的复合(γ- 的 Fe 2 O 3,4.9克/厘米3)和80%的活性剂被假定,这给的近似1.78克/ cm 3的密度和50的相对导磁率。了γ-Fe 2 O 3的选择是由于其低细胞毒性的。铁(3+)离子广泛存在于人体和略高离子浓度不会引起显著副作用23。
Protocol
Representative Results
Discussion
一个联动图像CFD方法在这项研究中,纳入基于图像的模式发展,以质量网格化,气流模拟和磁性粒子跟踪介绍。多个软件模块实施了这一目的,其中包括医疗图像,重建/解剖学精确气道模型的啮合,和流粒子模拟分割的功能。采用这种数值计算方法,三个鼻内递送协议性能进行了测试,并进行比较。相比, 在体外实验中 ,这种方法是在成本和时间效率更高;由此可进行大量的数字测…
Disclosures
The authors have nothing to disclose.
Acknowledgements
这项研究是由密歇根大学创新研究资助P421071和早期职业格兰特P622911资助。
Materials
| MIMICS 13 | Materialise Inc, Ann Arbor, MI | MR image segmentation | |
| Gambit | ANSYS Inc, Canonsburg, PA | Model development | |
| ANSYS ICEMCFD | ANSYS Inc, Canonsburg, PA | Meshing | |
| ANSYS Fluent | ANSYS Inc, Canonsburg, PA | Fluid and particle simulation | |
| COMSOL Multiphsics | COMSOL Inc, Burlington, MA | Magnetic particle tracing |
References
- Mistry, A., Stolnik, S., Illum, L. Nanoparticles for direct nose-to-brain delivery of drugs. Int. J. Pharm. 379 (1), 146-157 (2009).
- Alam, S., et al. Development and evaluation of thymoquinone-encapsulated chitosan nanoparticles for nose-to-brain targeting: a pharmacoscintigraphic study. Int. J. Nanomedicine. 7 (11), 5705-5718 (2012).
- Shi, H., Kleinstreuer, C., Zhang, Z. Laminar airflow and nanoparticle or vapor deposition in a human nasal cavity model. J. Biomech. Eng. 128 (5), 697-706 (2006).
- Si, X., Xi, J., Kim, J., Zhou, Y., Zhong, H. Modeling of release position and ventilation effects on olfactory aerosol drug delivery. Respir. Physiol. Neurobiol. 186 (1), 22-32 (2013).
- Si, X., Xi, J., Kim, J. Effect of laryngopharyngeal anatomy on expiratory airflow and submicrometer particle deposition in human extrathoracic airways. Open J. Fluid D. 3 (4), 286-301 (2013).
- Xi, J., Longest, P. W. Numerical predictions of submicrometer aerosol deposition in the nasal cavity using a novel drift flux approach. Int. J. Heat Mass Transfer. 51 (23), 5562-5577 (2008).
- Illum, L. Nasal drug delivery: new developments and strategies. Drug Discov. Today. 7 (23), 1184-1189 (2002).
- El Taoum, K. K., Xi, J., Kim, J. W., Berlinski, A. In vitro evaluation of aerosols delivered via the nasal route. Respir. Care. 60 (7), 1015-1025 (2015).
- Misra, A., Kher, G. Drug delivery systems from nose to brain. Curr. Pharm. Biotechnol. 13 (12), 2355-2379 (2012).
- Hoekman, J. D., Ho, R. J. Y. Effects of Localized Hydrophilic Mannitol and Hydrophobic Nelfinavir Administration Targeted to Olfactory Epithelium on Brain Distribution. Aaps Pharmscitech. 12 (2), 534-543 (2011).
- Corley, R. A., et al. Comparative Computational Modeling of Airflows and Vapor Dosimetry in the Respiratory Tracts of Rat, Monkey, and Human. Toxicol. Sci. 128 (2), 500-516 (2012).
- Shi, H., Kleinstreuer, C., Zhang, Z. Modeling of inertial particle transport and deposition in human nasal cavities with wall roughness. J. Aerosol Sci. 38 (4), 398-419 (2007).
- Kleinstreuer, C., Zhang, Z., Donohue, J. F. Targeted drug-aerosol delivery in human respiratory system. Annu. Rev. Biomed. Eng. 10 (4), 195-220 (2008).
- Kleinstreuer, C., Zhang, Z., Li, Z., Roberts, W. L., Rojas, C. A new methodology for targeting drug-aerosols in the human respiratory system. Int. J. Heat Mass Transfer. 51 (23), 5578-5589 (2008).
- Wilson, I. B. The deposition of charged particles in tubes, with reference to the retention of therapeutic aerosols in the human lung. J. Colloid Sci. 2 (2), 271-276 (1947).
- Wong, J., Chan, H. -. K., Kwok, P. C. L. Electrostatics in pharmaceutical aerosols for inhalation. Ther Deliv. 4 (8), 981-1002 (2013).
- Bailey, A. G. The inhalation and deposition of charged particles within the human lung. Journal of Electrostatics. 42 (1), 25-32 (1997).
- Xi, J., Si, X. A., Gaide, R. Electrophoretic particle guidance significantly enhances olfactory drug delivery: a feasibility study. PLoS ONE. 9 (1), e86593 (2014).
- Martin, A., Finlay, W. Alignment of magnetite-loaded high aspect ratio aerosol drug particles with magnetic fields. Aerosol Sci. Technol. 42 (4), 295-298 (2008).
- Dames, P., et al. Targeted delivery of magnetic aerosol droplets to the lung. Nature Nanotechnology. 2 (8), 495-499 (2007).
- Xi, J., Longest, P. W. Transport and deposition of micro-aerosols in realistic and simplified models of the oral airway. Ann. Biomed. Eng. 35 (4), 560-581 (2007).
- Longest, P. W., Xi, J. Effectiveness of direct Lagrangian tracking models for simulating nanoparticle deposition in the upper airways. Aerosol Sci. Technol. 41 (4), 380-397 (2007).
- Xi, J., Zhang, Z., Si, X. A., Yang, J., Deng, W. Optimization of magnetophoretic-guided drug delivery to the olfactory region in a human nose model. Biomech. Model. Mechanobiol. In. , (2015).
- Longest, P. W., Hindle, M., Das Choudhuri, S., Xi, J. X. Comparison of ambient and spray aerosol deposition in a standard induction port and more realistic mouth-throat geometry. J. Aerosol Sci. 39 (7), 572-591 (2008).
- Xi, J., et al. Design and Testing of Electric-Guided Delivery of Charged Particles to the Olfactory Region: Experimental and Numerical Studies. Curr. Drug Deliv. 13 (9), 1-15 (2015).
- Zhou, Y., Guo, M., Xi, J., Irshad, H., Cheng, Y. -. S. Nasal deposition in infants and children. Journal of aerosol medicine and pulmonary drug delivery. 27 (2), 110-116 (2014).
- Xi, J., Yuan, J. E., Si, X. A., Hasbany, J. Numerical optimization of targeted delivery of charged nanoparticles to the ostiomeatal complex for treatment of rhinosinusitis. Int. J. Nanomedicine. 10 (7), 4847-4861 (2015).

