Modellering en simulaties van olfactorische Drug Delivery met passieve en actieve controles van nasaal inhalatie medische aërosolen
Summary
This manuscript reviews the modeling and simulations of different protocols to deliver medications to the olfactory region in image-based nasal airway models. Multiple software modules are used to develop the anatomically accurate nose model, generate computational mesh, simulate nasal airflows, and predict particle deposition at the olfactory region.
Abstract
Er zijn vele voordelen van directe geneesmiddelafgifte neus naar de hersenen bij de behandeling van neurologische aandoeningen. Echter, wordt de toepassing beperkt door de extreem lage levering efficiëntie (<1%) tot de olfactorische mucosa die rechtstreeks verbindt de hersenen. Het is essentieel om nieuwe technieken ontwikkelen om neurologische geneesmiddelen efficiënter kan worden uitgevoerd om de olfactorische gebied. Het doel van deze studie is een numerieke platform te simuleren en intranasale olfactorische geneesmiddelafgifte verbeteren. Een beeld per-CFD methode werd voorgesteld dat de image-based model ontwikkeling, de kwaliteit meshing, vloeiende simulatie, en magnetische deeltjes volgen gesynthetiseerd. Met deze werkwijze werden drie uitvoeringen intranasale leveringsprotocollen numeriek geëvalueerd en vergeleken. Invloeden van de ademhaling manoeuvres, magneet lay-out, magnetische veldsterkte, geneesmiddelafgifte positie en deeltjesgrootte op de olfactorische dosering werden ook numeriek bestudeerd.
Van de simulations, vonden we dat klinisch significante olfactorische dosering (tot 45%) waren mogelijk met behulp van de combinatie van magneet lay-out en selectieve geneesmiddelafgifte. Een 64-voudige hogere afgifte van dosering werd voorspeld in het geval magnetophoretic begeleiding vergelijking met het geval zonder. Echter, de exacte geleiding van nasaal geïnhaleerde aerosolen het olfactorische gebied blijft moeilijk vanwege de instabiliteit van magnetophoresis, alsmede de hoge gevoeligheid van olfactorische dosering patiënt-, apparaat- en deeltjes factoren.
Introduction
Geneesmiddelen die aan het olfactorische gebied kan de bloed-hersenbarrière omzeilen en direct in de hersenen, wat leidt tot een efficiënte opname en snelle actie begin van de drugs 1,2. Echter, conventionele nasale inrichtingen, zoals nasale sprays en pompen leveren zeer lage doses aan het olfactorische gebied (<1%) via de nasale route 3,4. Het is vooral door de gecompliceerde structuur van de menselijke neus die bestaat uit smalle, kronkelige doorgangen (Figuur 1). De olfactorische gebied lokaliseert boven de superieure gehoorgang, waar slechts een zeer klein deel van de ingeademde lucht kan bereiken 5,6. Voorts gebruikelijke inhalatoren afhankelijk aërodynamische krachten om therapeutische middelen te vervoeren naar het doelgebied 7. Er is verder geen controle over de bewegingen van de deeltjes na hun vrijlating. Daarom is het transport en de afzetting van deze deeltjes voornamelijk afhankelijk van hun aanvankelijke snelheden en posities afgifte. verschuldigdde ingewikkelde neusholte en het gebrek aan controle deeltje, de meeste geneesmiddeldeeltjes worden gevangen in de voorste neus en kan het olfactorische gebied 8 niet bereikt.
Terwijl er veel keuzes van nasale apparaten, die speciaal is ontworpen voor gerichte olfactorische levering zijn zelden gemeld 7,9. Een uitzondering is Hoekman en Ho 10 die een geur-preferentiële afgifte inrichting ontwikkeld en gedemonstreerd hogere cortex-bloed geneesmiddelconcentraties in ratten tegenstelling tot het gebruik van een neusdruppel. Echter, het schalen van de afzettingsresultaten in ratten mens is niet eenvoudig, aangezien de grote anatomische en fysiologische verschillen tussen deze twee soorten 11. Veel beperkingen bestaan bij het gebruik van aangepaste versies van standaard nasale inrichtingen voor olfactorische leveringen. Één primaire nadeel is dat slechts een klein deel van medicijnen kan worden geleverd aan het olfactorische slijmvlies, waardoor de medicatie kan het invoerenhersenen. Numerieke modellering voorspelde dat minder dan 0,5% van intranasaal toegediende nanodeeltjes kunnen deponeren in het olfactorische gebied 3,5. De afzetting tarief nog lager (0,007%) voor micrometer deeltjes 12. Om de neus-tot-hersenen leveren klinisch haalbaar, de olfactorische depositiesnelheid moet aanzienlijk worden verbeterd.
Er bestaan verschillende mogelijke benaderingen van het olfactorische levering te verbeteren. Een benadering is het door Kleinstreuer et al. 13 voorgesteld als deeltjes afzetten in een regio voornamelijk uit een specifiek gebied aan de inlaat slimme inhalator idee is het mogelijk om deeltjes te leveren aan de doelplaats slechts deze vanuit bepaalde gebieden bij de inlaat . De slimme afleveringstechniek is aangetoond dat veel efficiënter longen gebracht dan gebruikelijke werkwijzen gegenereerd. 13,14 hypothese is dat deze slimme levering gedachte ook intranasaal geneesmiddelafgifte kunnen worden toegepast improve doseringen de olfactorische mucosa. Door het vrijgeven van deeltjes in verschillende functies bij het neusgat opening en vanuit verschillende diepten in de neusholte, verbeterde olfactorische levering efficiëntie en verminderde geneesmiddel afval in de voorste neus zijn mogelijk.
Een andere mogelijke methode is actieve regeling van de beweging van de deeltjes binnen de neusholte met verschillende veldkrachten, zoals elektrische of magnetische kracht. Elektrische bediening van geladen deeltjes is voorgesteld voor gerichte geneesmiddelafgifte aan de menselijke neus en longen 15-17. Xi et al. 18 numeriek testte de prestaties van elektrische geleiding van geladen deeltjes en voorspelde aanzienlijk verbeterd olfactorische doses. Evenzo begeleiding van ferromagnetische geneesmiddeldeeltjes met een geschikt magneetveld heeft ook het potentieel om deeltjes tot de olfactorische mucosa targeten. Gedrag van geïnhaleerde middelen mogelijk ferromagnetisch, kan worden gewijzigd door instelling van geschikte magnetische krachten <sup> 19. Dames et al. 20 aangetoond dat het praktisch ferromagnetische deeltjes specifieke gebieden muizenlongen targeten. Door verpakkingselementen geneesmiddelen met superparamagnetische ijzeroxide nanodeeltjes, werd de afzetting in één long van muizen onder invloed van een sterk magnetisch veld aanzienlijk toegenomen in vergelijking met de andere long 20.
Deeltjes werden verondersteld bolvormig en varieerde van 150 nm tot 30 pm in diameter. De inrichtende macht vergelijking is 21:
(1) 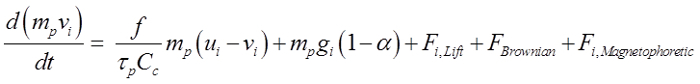
De bovenstaande vergelijking beschrijft de beweging van een deeltje beheerst door sleepkracht, zwaartekracht, Saffman lift kracht 22, Brownse kracht voor nanodeeltjes en magnetophoretic kracht indien geplaatst in een magnetisch veld. Hier, vi is het deeltjessnelheid, u i is de stroomsnelheid τ phet deeltje responstijd, C c de Cunningham correctiefactor, en α is de dichtheid verhouding lucht / deeltje. Om effectief gids intranasaal toegediende geneesmiddelen aan het olfactorische gebied, is het noodzakelijk dat de toegepaste magnetophoretic krachten op zowel het deeltje traagheid en zwaartekracht te overwinnen. In deze studie, een samenstelling van 20% maghemiet (γ-Fe 2 O 3, 4,9 g / cm 3) en 80% actieve stof werd aangenomen dat een dichtheid benaderde 1,78 g / cm3 en een relatieve permeabiliteit van 50 geven. de selectie van γ-Fe 2 O 3 was vanwege de lage cytotoxische. Ijzer (3+) -ionen zijn algemeen gevonden in het menselijk lichaam en een iets hogere ionconcentratie niet significante neveneffecten 23 veroorzaakt.
Protocol
Representative Results
Discussion
Een beeld per-CFD-methode werd in deze studie dat opgenomen de image-based model ontwikkeling, de kwaliteit meshing, luchtstroming simulatie, en magnetische deeltjes tracking. Meerdere softwaremodules zijn uitgevoerd om dit doel worden de functies van segmentatie van medische beelden, reconstructie / weven van anatomisch correcte modellen luchtwegen en stroom-deeltjes simulaties inbegrepen. Met deze numerieke methode, prestaties van drie intranasale afgifte protocollen werden getest en vergeleken. Vergeleken met in …
Disclosures
The authors have nothing to disclose.
Acknowledgements
Deze studie werd gefinancierd door de Central Michigan University Innovative Research Grant P421071 en Early Career Grant P622911.
Materials
| MIMICS 13 | Materialise Inc, Ann Arbor, MI | MR image segmentation | |
| Gambit | ANSYS Inc, Canonsburg, PA | Model development | |
| ANSYS ICEMCFD | ANSYS Inc, Canonsburg, PA | Meshing | |
| ANSYS Fluent | ANSYS Inc, Canonsburg, PA | Fluid and particle simulation | |
| COMSOL Multiphsics | COMSOL Inc, Burlington, MA | Magnetic particle tracing |
References
- Mistry, A., Stolnik, S., Illum, L. Nanoparticles for direct nose-to-brain delivery of drugs. Int. J. Pharm. 379 (1), 146-157 (2009).
- Alam, S., et al. Development and evaluation of thymoquinone-encapsulated chitosan nanoparticles for nose-to-brain targeting: a pharmacoscintigraphic study. Int. J. Nanomedicine. 7 (11), 5705-5718 (2012).
- Shi, H., Kleinstreuer, C., Zhang, Z. Laminar airflow and nanoparticle or vapor deposition in a human nasal cavity model. J. Biomech. Eng. 128 (5), 697-706 (2006).
- Si, X., Xi, J., Kim, J., Zhou, Y., Zhong, H. Modeling of release position and ventilation effects on olfactory aerosol drug delivery. Respir. Physiol. Neurobiol. 186 (1), 22-32 (2013).
- Si, X., Xi, J., Kim, J. Effect of laryngopharyngeal anatomy on expiratory airflow and submicrometer particle deposition in human extrathoracic airways. Open J. Fluid D. 3 (4), 286-301 (2013).
- Xi, J., Longest, P. W. Numerical predictions of submicrometer aerosol deposition in the nasal cavity using a novel drift flux approach. Int. J. Heat Mass Transfer. 51 (23), 5562-5577 (2008).
- Illum, L. Nasal drug delivery: new developments and strategies. Drug Discov. Today. 7 (23), 1184-1189 (2002).
- El Taoum, K. K., Xi, J., Kim, J. W., Berlinski, A. In vitro evaluation of aerosols delivered via the nasal route. Respir. Care. 60 (7), 1015-1025 (2015).
- Misra, A., Kher, G. Drug delivery systems from nose to brain. Curr. Pharm. Biotechnol. 13 (12), 2355-2379 (2012).
- Hoekman, J. D., Ho, R. J. Y. Effects of Localized Hydrophilic Mannitol and Hydrophobic Nelfinavir Administration Targeted to Olfactory Epithelium on Brain Distribution. Aaps Pharmscitech. 12 (2), 534-543 (2011).
- Corley, R. A., et al. Comparative Computational Modeling of Airflows and Vapor Dosimetry in the Respiratory Tracts of Rat, Monkey, and Human. Toxicol. Sci. 128 (2), 500-516 (2012).
- Shi, H., Kleinstreuer, C., Zhang, Z. Modeling of inertial particle transport and deposition in human nasal cavities with wall roughness. J. Aerosol Sci. 38 (4), 398-419 (2007).
- Kleinstreuer, C., Zhang, Z., Donohue, J. F. Targeted drug-aerosol delivery in human respiratory system. Annu. Rev. Biomed. Eng. 10 (4), 195-220 (2008).
- Kleinstreuer, C., Zhang, Z., Li, Z., Roberts, W. L., Rojas, C. A new methodology for targeting drug-aerosols in the human respiratory system. Int. J. Heat Mass Transfer. 51 (23), 5578-5589 (2008).
- Wilson, I. B. The deposition of charged particles in tubes, with reference to the retention of therapeutic aerosols in the human lung. J. Colloid Sci. 2 (2), 271-276 (1947).
- Wong, J., Chan, H. -. K., Kwok, P. C. L. Electrostatics in pharmaceutical aerosols for inhalation. Ther Deliv. 4 (8), 981-1002 (2013).
- Bailey, A. G. The inhalation and deposition of charged particles within the human lung. Journal of Electrostatics. 42 (1), 25-32 (1997).
- Xi, J., Si, X. A., Gaide, R. Electrophoretic particle guidance significantly enhances olfactory drug delivery: a feasibility study. PLoS ONE. 9 (1), e86593 (2014).
- Martin, A., Finlay, W. Alignment of magnetite-loaded high aspect ratio aerosol drug particles with magnetic fields. Aerosol Sci. Technol. 42 (4), 295-298 (2008).
- Dames, P., et al. Targeted delivery of magnetic aerosol droplets to the lung. Nature Nanotechnology. 2 (8), 495-499 (2007).
- Xi, J., Longest, P. W. Transport and deposition of micro-aerosols in realistic and simplified models of the oral airway. Ann. Biomed. Eng. 35 (4), 560-581 (2007).
- Longest, P. W., Xi, J. Effectiveness of direct Lagrangian tracking models for simulating nanoparticle deposition in the upper airways. Aerosol Sci. Technol. 41 (4), 380-397 (2007).
- Xi, J., Zhang, Z., Si, X. A., Yang, J., Deng, W. Optimization of magnetophoretic-guided drug delivery to the olfactory region in a human nose model. Biomech. Model. Mechanobiol. In. , (2015).
- Longest, P. W., Hindle, M., Das Choudhuri, S., Xi, J. X. Comparison of ambient and spray aerosol deposition in a standard induction port and more realistic mouth-throat geometry. J. Aerosol Sci. 39 (7), 572-591 (2008).
- Xi, J., et al. Design and Testing of Electric-Guided Delivery of Charged Particles to the Olfactory Region: Experimental and Numerical Studies. Curr. Drug Deliv. 13 (9), 1-15 (2015).
- Zhou, Y., Guo, M., Xi, J., Irshad, H., Cheng, Y. -. S. Nasal deposition in infants and children. Journal of aerosol medicine and pulmonary drug delivery. 27 (2), 110-116 (2014).
- Xi, J., Yuan, J. E., Si, X. A., Hasbany, J. Numerical optimization of targeted delivery of charged nanoparticles to the ostiomeatal complex for treatment of rhinosinusitis. Int. J. Nanomedicine. 10 (7), 4847-4861 (2015).

