経鼻吸入医薬品エアロゾルのパッシブとアクティブコントロールを使用した嗅覚ドラッグデリバリーのモデリングとシミュレーション
Summary
This manuscript reviews the modeling and simulations of different protocols to deliver medications to the olfactory region in image-based nasal airway models. Multiple software modules are used to develop the anatomically accurate nose model, generate computational mesh, simulate nasal airflows, and predict particle deposition at the olfactory region.
Abstract
神経障害の治療における直接鼻から脳への薬物送達の多くの利点があります。しかし、そのアプリケーションが直接脳を結ぶ嗅粘膜への非常に低い送達効率(<1%)によって制限されます。嗅覚領域に、より効果的に神経学的薬剤を送達するための新たな技術を開発することが重要です。本研究の目的は、シミュレートおよび鼻腔の嗅覚薬物送達を改善するための数値プラットフォームを開発することです。結合画像CFD方法は、画像ベースのモデル開発、品質噛み合い、流体シミュレーション、及び磁性粒子追跡を合成し、その提示されました。この方法で三鼻腔内送達プロトコルの性能を数値的に評価し、比較しました。呼吸操縦、磁石配置、磁界強度、薬物放出位置、及び嗅覚用量の粒子サイズの影響も数値的に調べました。
Sからimulations、我々は(45%まで)臨床的に有意な嗅覚投与量は、磁石のレイアウトと選択的薬物放出の組み合わせを用いて実現可能であることがわかりました。投与量の64倍高い配信は、それがない場合に比べて磁気泳動指導の場合に予測されました。しかし、嗅覚の領域に経鼻吸入エアロゾルの正確な指導が原因磁気泳動の不安定な性質だけでなく、嗅覚patient-する用量、デバイス – 、および粒子関連因子の高感度に依然として厳しいです。
Introduction
嗅覚領域に送達される薬物は、血液脳関門をバイパスし、直接脳に入る、効率的な取り込みおよび薬物1,2の迅速な行動の発症につながることができます。しかし、このような鼻ポンプやスプレーなどの従来の鼻のデバイスは、鼻経路3,4を介して(<1%)嗅覚領域に非常に低用量を提供します。これは主に狭い、入り組んだ通路( 図1)から構成されているヒトの鼻の複雑な構造に起因します。嗅覚領域は、吸入空気のごく小さな部分が5,6に到達することができ、優れた道、上に位置します。また、従来の吸入装置は、対象領域7に治療薬を輸送する空気力学的な力に依存します。それらの放出後の粒子の動きに対して何らさらなる制御はありません。したがって、これらの粒子の輸送と沈着は主に彼らの初期の速度とリリース位置に依存します。原因入り組ん鼻通路だけでなく、粒子制御の不足のために、薬物粒子の大部分は、前鼻の中に閉じ込められ、嗅覚領域8に到達することはできません。
鼻のデバイスの多くの選択肢がありますが、特異的に標的嗅覚送達のために設計されたものはほとんど7,9を報告されていません。唯一の例外は、嗅覚-優先送達デバイスを開発し、鼻ドロップを使用するのではなく、ラットで高い皮質対血液薬物レベルを実証しフークマンとホー10です。しかし、人間にラットにおける成膜結果をスケーリングすることは、これらの2種11との間の広大な解剖学的および生理学的な違いを考慮し、簡単ではありません。嗅覚配達のための標準的な鼻デバイスの適応バージョンを使用すると、多くの制限が存在します。一つの主要な後退は、薬のごく小さな部分が薬が入ることがあり、それを通して鼻粘膜に送達することができるということです脳。数値モデリングは、鼻腔内投与したナノ粒子の0.5%未満が嗅覚領域3,5に堆積することができると予測しました。堆積速度は、マイクロ粒子の12(0.007%)も低いです。鼻から脳への送達は、臨床的に実行可能にするために、嗅覚の堆積速度を大幅に改善する必要があります。
嗅覚送達を改善するためのいくつかの可能なアプローチが存在します。一つのアプローチは、一つの領域に堆積した粒子は、主に入口の一つの特定の領域からのものであるようにKleinstreuer ら 13によって提案されたスマートな吸入器のアイデアですが、入口で特定の領域からのみ、それらを解放することにより、標的部位に粒子を送達することが可能です。スマートデリバリー技術は、従来の方法よりもはるかに効率的な肺送達を生成することが示されている。13,14なお、このスマートデリバリーアイデアもIに鼻腔内薬物送達に適用することができると仮定されます嗅粘膜へのmprove用量。鼻孔の開口部に及び鼻腔内の異なる深さから別の位置に粒子を放出することによって、嗅覚配信効率を改善し、前方の鼻の中に薬物の廃棄物を減少することが可能です。
別の可能な方法は、積極的に、電気や磁気力、フィールド力のさまざまな方法を使って、鼻腔内の粒子の動きを制御することです。荷電粒子の電気的制御は、ヒトの鼻や肺15-17への標的薬物送達のために示唆されています。西ら 18は、数値的に荷電粒子の電気指導の性能をテストし、大幅に改善された嗅覚投与量を予測しました。同様に、適切な磁場を持つ強磁性薬物粒子のガイダンスはまた、鼻粘膜への粒子を対象とする可能性を秘めています。吸入薬の挙動は、強磁性場合、適切な磁力を課すことによって変更することができます<suP> 19。ダムら 20は 、マウス肺内の特定の領域に強磁性粒子を標的化するために実用的であることを実証しました。超常磁性酸化鉄ナノ粒子で治療薬を包装することにより、強磁場の影響下でのマウスの肺における沈着はかなり他の肺20と比較して増加しました。
粒子は球状であると仮定し、直径が150ナノメートル〜30μmの範囲でした。支配方程式は21です。
(1) 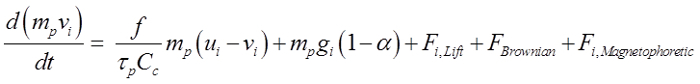
上記の式は、磁場中に置かれた場合にドラグ力、重力、サフマン揚力22、ナノ粒子のためのブラウン力、および磁気泳動力によって支配粒子の動きを説明しています。ここで、vがiは 、τpは 、流速で、uの粒子速度であります粒子の応答時間は、C cはカニンガム補正係数であり、αは、空気/粒子密度の比です。効果的に嗅覚領域に鼻腔内投与された薬物を導くために、適用される磁気泳動力が粒子の慣性と重力の両方を克服するために必要です。この研究では、20%のマグヘマイト(γ-Fe 2 O 3 4.9グラム/ cm 3)を、80%の活性薬剤を仮定した、おおよそ1.78グラム/ cm 3の密度及び50の相対的な透過性を与えているの合成。 γ-Fe系2 O 3の選択は、その低細胞毒性によるものでした。鉄(3+)イオンが広く人体中に見出され、わずかに高いイオン濃度は有意な副作用23が発生することはありません。
Protocol
Representative Results
Discussion
結合された画像CFD方法は、画像ベースのモデルの開発、品質噛み合い、気流シミュレーション、および磁性粒子追跡を組み込ま本研究で提示されました。複数のソフトウェア・モジュールは、医用画像、再構成/解剖学的に正確な気道モデルの噛み合い、及びフロー粒子シミュレーションの分割の機能が含まれ、この目的に実施されました。この数値的方法を使用して、3つの鼻腔内送達プロ?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
この研究は、中央ミシガン大学の革新的な研究助成P421071と初期のキャリアグラントP622911によって賄われていました。
Materials
| MIMICS 13 | Materialise Inc, Ann Arbor, MI | MR image segmentation | |
| Gambit | ANSYS Inc, Canonsburg, PA | Model development | |
| ANSYS ICEMCFD | ANSYS Inc, Canonsburg, PA | Meshing | |
| ANSYS Fluent | ANSYS Inc, Canonsburg, PA | Fluid and particle simulation | |
| COMSOL Multiphsics | COMSOL Inc, Burlington, MA | Magnetic particle tracing |
References
- Mistry, A., Stolnik, S., Illum, L. Nanoparticles for direct nose-to-brain delivery of drugs. Int. J. Pharm. 379 (1), 146-157 (2009).
- Alam, S., et al. Development and evaluation of thymoquinone-encapsulated chitosan nanoparticles for nose-to-brain targeting: a pharmacoscintigraphic study. Int. J. Nanomedicine. 7 (11), 5705-5718 (2012).
- Shi, H., Kleinstreuer, C., Zhang, Z. Laminar airflow and nanoparticle or vapor deposition in a human nasal cavity model. J. Biomech. Eng. 128 (5), 697-706 (2006).
- Si, X., Xi, J., Kim, J., Zhou, Y., Zhong, H. Modeling of release position and ventilation effects on olfactory aerosol drug delivery. Respir. Physiol. Neurobiol. 186 (1), 22-32 (2013).
- Si, X., Xi, J., Kim, J. Effect of laryngopharyngeal anatomy on expiratory airflow and submicrometer particle deposition in human extrathoracic airways. Open J. Fluid D. 3 (4), 286-301 (2013).
- Xi, J., Longest, P. W. Numerical predictions of submicrometer aerosol deposition in the nasal cavity using a novel drift flux approach. Int. J. Heat Mass Transfer. 51 (23), 5562-5577 (2008).
- Illum, L. Nasal drug delivery: new developments and strategies. Drug Discov. Today. 7 (23), 1184-1189 (2002).
- El Taoum, K. K., Xi, J., Kim, J. W., Berlinski, A. In vitro evaluation of aerosols delivered via the nasal route. Respir. Care. 60 (7), 1015-1025 (2015).
- Misra, A., Kher, G. Drug delivery systems from nose to brain. Curr. Pharm. Biotechnol. 13 (12), 2355-2379 (2012).
- Hoekman, J. D., Ho, R. J. Y. Effects of Localized Hydrophilic Mannitol and Hydrophobic Nelfinavir Administration Targeted to Olfactory Epithelium on Brain Distribution. Aaps Pharmscitech. 12 (2), 534-543 (2011).
- Corley, R. A., et al. Comparative Computational Modeling of Airflows and Vapor Dosimetry in the Respiratory Tracts of Rat, Monkey, and Human. Toxicol. Sci. 128 (2), 500-516 (2012).
- Shi, H., Kleinstreuer, C., Zhang, Z. Modeling of inertial particle transport and deposition in human nasal cavities with wall roughness. J. Aerosol Sci. 38 (4), 398-419 (2007).
- Kleinstreuer, C., Zhang, Z., Donohue, J. F. Targeted drug-aerosol delivery in human respiratory system. Annu. Rev. Biomed. Eng. 10 (4), 195-220 (2008).
- Kleinstreuer, C., Zhang, Z., Li, Z., Roberts, W. L., Rojas, C. A new methodology for targeting drug-aerosols in the human respiratory system. Int. J. Heat Mass Transfer. 51 (23), 5578-5589 (2008).
- Wilson, I. B. The deposition of charged particles in tubes, with reference to the retention of therapeutic aerosols in the human lung. J. Colloid Sci. 2 (2), 271-276 (1947).
- Wong, J., Chan, H. -. K., Kwok, P. C. L. Electrostatics in pharmaceutical aerosols for inhalation. Ther Deliv. 4 (8), 981-1002 (2013).
- Bailey, A. G. The inhalation and deposition of charged particles within the human lung. Journal of Electrostatics. 42 (1), 25-32 (1997).
- Xi, J., Si, X. A., Gaide, R. Electrophoretic particle guidance significantly enhances olfactory drug delivery: a feasibility study. PLoS ONE. 9 (1), e86593 (2014).
- Martin, A., Finlay, W. Alignment of magnetite-loaded high aspect ratio aerosol drug particles with magnetic fields. Aerosol Sci. Technol. 42 (4), 295-298 (2008).
- Dames, P., et al. Targeted delivery of magnetic aerosol droplets to the lung. Nature Nanotechnology. 2 (8), 495-499 (2007).
- Xi, J., Longest, P. W. Transport and deposition of micro-aerosols in realistic and simplified models of the oral airway. Ann. Biomed. Eng. 35 (4), 560-581 (2007).
- Longest, P. W., Xi, J. Effectiveness of direct Lagrangian tracking models for simulating nanoparticle deposition in the upper airways. Aerosol Sci. Technol. 41 (4), 380-397 (2007).
- Xi, J., Zhang, Z., Si, X. A., Yang, J., Deng, W. Optimization of magnetophoretic-guided drug delivery to the olfactory region in a human nose model. Biomech. Model. Mechanobiol. In. , (2015).
- Longest, P. W., Hindle, M., Das Choudhuri, S., Xi, J. X. Comparison of ambient and spray aerosol deposition in a standard induction port and more realistic mouth-throat geometry. J. Aerosol Sci. 39 (7), 572-591 (2008).
- Xi, J., et al. Design and Testing of Electric-Guided Delivery of Charged Particles to the Olfactory Region: Experimental and Numerical Studies. Curr. Drug Deliv. 13 (9), 1-15 (2015).
- Zhou, Y., Guo, M., Xi, J., Irshad, H., Cheng, Y. -. S. Nasal deposition in infants and children. Journal of aerosol medicine and pulmonary drug delivery. 27 (2), 110-116 (2014).
- Xi, J., Yuan, J. E., Si, X. A., Hasbany, J. Numerical optimization of targeted delivery of charged nanoparticles to the ostiomeatal complex for treatment of rhinosinusitis. Int. J. Nanomedicine. 10 (7), 4847-4861 (2015).

