Modélisation et simulations de Olfactive Drug Delivery avec les contrôles passifs et actifs de inhalés par voie nasale pharmaceutiques Aérosols
Summary
This manuscript reviews the modeling and simulations of different protocols to deliver medications to the olfactory region in image-based nasal airway models. Multiple software modules are used to develop the anatomically accurate nose model, generate computational mesh, simulate nasal airflows, and predict particle deposition at the olfactory region.
Abstract
Il existe de nombreux avantages de l'administration de médicaments directe nez-à-cerveau dans le traitement de troubles neurologiques. Cependant, son application est limitée par l'efficacité d'administration extrêmement faible (<1%) à la muqueuse olfactive qui se raccorde directement au cerveau. Il est crucial de développer des techniques de nouvelles pour fournir plus efficacement des médicaments neurologiques à la région olfactive. L'objectif de cette étude est de développer une plate-forme numérique pour simuler et améliorer la prestation olfactive intranasale de drogue. Une méthode d'image CFD couplé a été présenté que synthétisé le développement basé sur l'image modèle, maillage de qualité, simulation de fluide, et le suivi des particules magnétiques. Avec cette méthode, les performances de trois protocoles de livraison intranasale ont été évalués et comparés numériquement. Influences des manœuvres de respiration, la disposition de l'aimant, la force du champ magnétique, la position de libération du médicament, et la taille des particules sur le dosage olfactif ont également été numériquement étudiés.
De l'artimulations, nous avons constaté que la dose olfactive cliniquement significative (jusqu'à 45%) étaient réalisables en utilisant la combinaison de la mise en page de l'aimant et la libération du médicament sélectif. Une livraison 64 -fold supérieure de la dose a été prédit dans le cas des directives magnétophorétique par rapport au cas sans elle. Cependant, l'orientation précise des aérosols inhalés par voie nasale à la région olfactive reste difficile en raison de la nature instable du magnétophorèse, ainsi que la haute sensibilité du dosage olfactif PATIENT, device-, et les facteurs liés aux particules.
Introduction
Les médicaments livrés à la région olfactive peut contourner le sang-cerveau-barrière et directement entrer dans le cerveau, conduisant à une absorption efficace et le début d'action rapide des médicaments 1,2. Cependant, les dispositifs nasaux conventionnels tels que des pompes nasales et sprays délivrent des doses extrêmement faibles de la région olfactive (<1%) par voie nasale 3,4. Il est principalement en raison de la structure complexe du nez humain qui est composé de passages, alambiquées étroites (figure 1). La région olfactive localise au- dessus du méat supérieur, où seulement une très petite fraction d'air inhalé peut atteindre 5,6. En outre, les dispositifs d'inhalation classiques dépendent des forces aérodynamiques pour transporter des agents thérapeutiques vers la zone cible 7. Il n'y a pas encore de contrôle sur les mouvements des particules après leur libération. Par conséquent, le transport et le dépôt de ces particules dépendent essentiellement de leurs vitesses initiales et positions de libération. Dûle passage nasal alambiqué, ainsi que le manque de contrôle des particules, la majorité des particules de médicament sont pris au piège dans le nez antérieur et ne peut pas atteindre la région olfactive 8.
Bien qu'il existe de nombreux choix de dispositifs nasaux, ceux qui sont conçus spécifiquement pour la livraison olfactive ciblée ont rarement été rapporté 7,9. Une exception est Hoekman et Ho 10 qui a développé un dispositif de délivrance olfactif préférentiel et a démontré des niveaux plus élevés cortex-à-sang drogue chez le rat , par opposition à l' aide d' une goutte de nez. Cependant, à l' échelle les résultats de dépôt chez le rat à l' homme est pas simple, compte tenu des grandes différences anatomiques et physiologiques entre ces deux espèces 11. De nombreuses limitations existent lors de l'utilisation des versions adaptées de dispositifs nasales standard pour les livraisons olfactives. Un revers principal est que seule une très petite partie des médicaments peuvent être livrés à la muqueuse olfactive, à travers laquelle les médicaments peuvent entrer dans lacerveau. La modélisation numérique prédit que moins de 0,5% de nanoparticules administrées par voie intranasale peut se déposer dans la région de 3,5 olfactive. La vitesse de dépôt est encore plus faible (0,007%) pour les particules 12 micromètres. Afin de rendre la prestation nez-à-cerveau cliniquement possible, le taux de dépôt olfactif doit être considérablement améliorée.
Il existe plusieurs approches possibles pour améliorer la prestation olfactive. Une approche est l'idée de l' inhalateur intelligent proposé par Kleinstreuer et al. 13 Comme particules de dépôt dans une région sont principalement d'une zone spécifique à l'entrée, il est possible de délivrer des particules sur le site cible en les libérant uniquement de certaines zones à l'entrée . La technique de livraison à puce a été montré pour générer une livraison du poumon beaucoup plus efficace que les méthodes conventionnelles. 13,14 On suppose que cette idée de livraison à puce peut également être appliquée dans l' administration de médicaments par voie intranasale à imProve dosages à la muqueuse olfactive. En libérant des particules dans différentes positions à l'ouverture de la narine et de différentes profondeurs dans la cavité nasale, l'amélioration de l'efficacité de la livraison olfactifs et une réduction des déchets de la drogue dans le nez antérieur sont possibles.
Une autre méthode possible consiste à contrôler activement le mouvement des particules au sein de la cavité nasale en utilisant une variété de forces de champ, telles que la force électrique ou magnétique. Commande électrique des particules chargées a été suggéré pour la livraison ciblée des médicaments pour le nez et les poumons humains 15-17. Xi et al. 18 numériquement testé la performance de l' orientation électrique des particules chargées et prédit significativement améliorée doses olfactives. De même, l'orientation des particules de médicament ferromagnétiques ayant un champ magnétique approprié a également le potentiel de cibler les particules à la muqueuse olfactive. Comportements des agents inhalés, si ferromagnétique, peuvent être modifiés en imposant des forces magnétiques appropriés <sup> 19. Dames et al. 20 a démontré qu'il est pratique pour cibler des particules ferromagnétiques à des zones spécifiques dans les poumons de souris. Par emballage agents thérapeutiques avec des nanoparticules d'oxyde de fer superparamagnétiques, le dépôt dans un poumon d'une souris sous l'influence d'un fort champ magnétique a été considérablement augmenté par rapport à l'autre poumon 20.
On a supposé que les particules sphériques et ont varié de 150 nm à 30 um de diamètre. L'équation qui se 21:
(1) 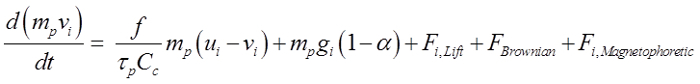
L'équation ci – dessus décrit le mouvement d'une particule régie par la force de traînée, la force gravitationnelle, Saffman force de levage 22, la force brownien pour les nanoparticules et la force magnétophorétique si elles sont placées dans un champ magnétique. Ici, v i est la vitesse des particules, u i est la vitesse d'écoulement, τ p est égal àle temps de réponse des particules, C c représente le facteur de correction Cunningham, et α est le rapport de la masse volumique air / particules. Afin de guider efficacement les médicaments administrés par voie intranasale à la région olfactive, il est nécessaire que les forces appliquées magnétophorétique à surmonter à la fois l'inertie des particules et de la force gravitationnelle. Dans cette étude, un composé de 20% de la maghémite (γ-Fe 2 O 3, de 4,9 g / cm3) et 80% d' agent actif a supposé, ce qui donne une densité d'environ 1,78 g / cm 3 et une perméabilité relative de 50. la sélection de γ-Fe 2 O 3 est dû à sa faible cytotoxique. Fer (3+) , les ions sont largement trouvé dans le corps humain et une concentration en ions légèrement plus élevée ne provoquera pas d'effets secondaires significatifs 23.
Protocol
Representative Results
Discussion
Une méthode d'image CFD couplé a été présenté dans cette étude qui a incorporé le développement basé sur l'image modèle, maillage qualité, simulation de flux d'air, et le suivi des particules magnétiques. Plusieurs modules logiciels ont été mis en œuvre à cet objectif, qui comprenait des fonctions de segmentation d'images médicales, la reconstruction / maillage des modèles des voies respiratoires anatomiquement précises, et des simulations flux de particules. En utilisant cette métho…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Cette étude a été financée par la Central Michigan University Innovative Research Grant P421071 et Early Career Grant P622911.
Materials
| MIMICS 13 | Materialise Inc, Ann Arbor, MI | MR image segmentation | |
| Gambit | ANSYS Inc, Canonsburg, PA | Model development | |
| ANSYS ICEMCFD | ANSYS Inc, Canonsburg, PA | Meshing | |
| ANSYS Fluent | ANSYS Inc, Canonsburg, PA | Fluid and particle simulation | |
| COMSOL Multiphsics | COMSOL Inc, Burlington, MA | Magnetic particle tracing |
References
- Mistry, A., Stolnik, S., Illum, L. Nanoparticles for direct nose-to-brain delivery of drugs. Int. J. Pharm. 379 (1), 146-157 (2009).
- Alam, S., et al. Development and evaluation of thymoquinone-encapsulated chitosan nanoparticles for nose-to-brain targeting: a pharmacoscintigraphic study. Int. J. Nanomedicine. 7 (11), 5705-5718 (2012).
- Shi, H., Kleinstreuer, C., Zhang, Z. Laminar airflow and nanoparticle or vapor deposition in a human nasal cavity model. J. Biomech. Eng. 128 (5), 697-706 (2006).
- Si, X., Xi, J., Kim, J., Zhou, Y., Zhong, H. Modeling of release position and ventilation effects on olfactory aerosol drug delivery. Respir. Physiol. Neurobiol. 186 (1), 22-32 (2013).
- Si, X., Xi, J., Kim, J. Effect of laryngopharyngeal anatomy on expiratory airflow and submicrometer particle deposition in human extrathoracic airways. Open J. Fluid D. 3 (4), 286-301 (2013).
- Xi, J., Longest, P. W. Numerical predictions of submicrometer aerosol deposition in the nasal cavity using a novel drift flux approach. Int. J. Heat Mass Transfer. 51 (23), 5562-5577 (2008).
- Illum, L. Nasal drug delivery: new developments and strategies. Drug Discov. Today. 7 (23), 1184-1189 (2002).
- El Taoum, K. K., Xi, J., Kim, J. W., Berlinski, A. In vitro evaluation of aerosols delivered via the nasal route. Respir. Care. 60 (7), 1015-1025 (2015).
- Misra, A., Kher, G. Drug delivery systems from nose to brain. Curr. Pharm. Biotechnol. 13 (12), 2355-2379 (2012).
- Hoekman, J. D., Ho, R. J. Y. Effects of Localized Hydrophilic Mannitol and Hydrophobic Nelfinavir Administration Targeted to Olfactory Epithelium on Brain Distribution. Aaps Pharmscitech. 12 (2), 534-543 (2011).
- Corley, R. A., et al. Comparative Computational Modeling of Airflows and Vapor Dosimetry in the Respiratory Tracts of Rat, Monkey, and Human. Toxicol. Sci. 128 (2), 500-516 (2012).
- Shi, H., Kleinstreuer, C., Zhang, Z. Modeling of inertial particle transport and deposition in human nasal cavities with wall roughness. J. Aerosol Sci. 38 (4), 398-419 (2007).
- Kleinstreuer, C., Zhang, Z., Donohue, J. F. Targeted drug-aerosol delivery in human respiratory system. Annu. Rev. Biomed. Eng. 10 (4), 195-220 (2008).
- Kleinstreuer, C., Zhang, Z., Li, Z., Roberts, W. L., Rojas, C. A new methodology for targeting drug-aerosols in the human respiratory system. Int. J. Heat Mass Transfer. 51 (23), 5578-5589 (2008).
- Wilson, I. B. The deposition of charged particles in tubes, with reference to the retention of therapeutic aerosols in the human lung. J. Colloid Sci. 2 (2), 271-276 (1947).
- Wong, J., Chan, H. -. K., Kwok, P. C. L. Electrostatics in pharmaceutical aerosols for inhalation. Ther Deliv. 4 (8), 981-1002 (2013).
- Bailey, A. G. The inhalation and deposition of charged particles within the human lung. Journal of Electrostatics. 42 (1), 25-32 (1997).
- Xi, J., Si, X. A., Gaide, R. Electrophoretic particle guidance significantly enhances olfactory drug delivery: a feasibility study. PLoS ONE. 9 (1), e86593 (2014).
- Martin, A., Finlay, W. Alignment of magnetite-loaded high aspect ratio aerosol drug particles with magnetic fields. Aerosol Sci. Technol. 42 (4), 295-298 (2008).
- Dames, P., et al. Targeted delivery of magnetic aerosol droplets to the lung. Nature Nanotechnology. 2 (8), 495-499 (2007).
- Xi, J., Longest, P. W. Transport and deposition of micro-aerosols in realistic and simplified models of the oral airway. Ann. Biomed. Eng. 35 (4), 560-581 (2007).
- Longest, P. W., Xi, J. Effectiveness of direct Lagrangian tracking models for simulating nanoparticle deposition in the upper airways. Aerosol Sci. Technol. 41 (4), 380-397 (2007).
- Xi, J., Zhang, Z., Si, X. A., Yang, J., Deng, W. Optimization of magnetophoretic-guided drug delivery to the olfactory region in a human nose model. Biomech. Model. Mechanobiol. In. , (2015).
- Longest, P. W., Hindle, M., Das Choudhuri, S., Xi, J. X. Comparison of ambient and spray aerosol deposition in a standard induction port and more realistic mouth-throat geometry. J. Aerosol Sci. 39 (7), 572-591 (2008).
- Xi, J., et al. Design and Testing of Electric-Guided Delivery of Charged Particles to the Olfactory Region: Experimental and Numerical Studies. Curr. Drug Deliv. 13 (9), 1-15 (2015).
- Zhou, Y., Guo, M., Xi, J., Irshad, H., Cheng, Y. -. S. Nasal deposition in infants and children. Journal of aerosol medicine and pulmonary drug delivery. 27 (2), 110-116 (2014).
- Xi, J., Yuan, J. E., Si, X. A., Hasbany, J. Numerical optimization of targeted delivery of charged nanoparticles to the ostiomeatal complex for treatment of rhinosinusitis. Int. J. Nanomedicine. 10 (7), 4847-4861 (2015).

