Uso di singola molecola fluorescente ibridazione In Situ (SM-pesce) per quantificare e Localize mRNAs in ovociti murini
Summary
Per riproducibile contare i numeri dei mRNAs in singoli ovociti, in situ di fluorescenza di singola molecola del RNA (RNA-pesce) l’ibridazione è stato ottimizzato per cellule non aderenti. Gli ovociti sono stati raccolti, ibridata con le sonde specifiche di trascrizione e quantificati tramite un software di quantificazione di immagine.
Abstract
Attuali metodi abitualmente utilizzati per quantificare il mRNA di ovociti ed embrioni includono reazione a catena della polimerasi d’inversione-trascrizione digitale (dPCR), quantitativa, Real-Time RT-PCR (RT-qPCR) e sequenziamento di RNA. Quando queste tecniche vengono eseguite utilizzando un singolo oocita o embrione, basso-copia mRNA non vengono rilevati in modo affidabile. Per ovviare a questo problema, gli ovociti o embrioni possono essere riuniti insieme per analisi; Tuttavia, questo porta spesso a un’elevata variabilità tra i campioni. In questo protocollo, descriviamo l’uso di ibridazione fluorescente in situ (FISH) utilizzando la chimica del DNA ramificato. Questa tecnica identifica il pattern spazio dei mRNAs in singole celle. Quando la tecnica è accoppiata con ricerca di Spot e software di monitoraggio computer, l’abbondanza del mRNA nella cellula anche può essere quantificato. Utilizzando questa tecnica, c’è ridotta variabilità all’interno di un gruppo sperimentale e un minor numero di ovociti ed embrioni sono necessarie per rilevare differenze significative tra i gruppi sperimentali. Commercialmente disponibile DNA ramificato SM-Kit di pesce sono stati ottimizzati per rilevare mRNAs in sezionato tessuti o cellule aderenti sulle diapositive. Tuttavia, gli ovociti non aderiscono in modo efficace alle diapositive e alcuni reagenti contenuti nel kit erano troppo duri con conseguente lisi degli ovociti. Per evitare questo Lisi, diverse modifiche sono state fatte per il kit di pesce. In particolare, il buffer di permeabilizzazione e lavaggio di ovocita progettato per l’immunofluorescenza di ovociti ed embrioni sostituito i buffer proprietari. La permeabilizzazione, lavaggi e le incubazioni con sonde e amplificatore sono state eseguite in piastre da 6 pozzetti e ovociti sono stati collocati sulle diapositive alla fine del protocollo utilizzando mezzi di montaggio. Queste modifiche sono state in grado di superare le limitazioni del kit disponibili in commercio, in particolare, la lisi dell’ovocita. Per accurato e riproducibile contare il numero dei mRNAs in singoli ovociti, software per computer è stato utilizzato. Insieme, questo protocollo rappresenta un’alternativa alla PCR e sequenziamento per confrontare l’espressione di specifici trascritti in singole cellule.
Introduction
Reazione a catena d’inversione-transcriptase della polimerasi (PCR) è stato il gold standard per la quantificazione di mRNA. Due saggi, digitale PCR (dPCR)1 e quantitativa in tempo reale PCR (qPCR)2 sono attualmente utilizzati. Le due tecniche di PCR, dPCR ha una maggiore sensibilità rispetto qPCR suggerendo che potrebbe essere utilizzato per misurare l’abbondanza del mRNA in singole cellule. Tuttavia, nelle nostre mani, dPCR analisi dei mRNAs abbondanza bassa nelle piscine di ovociti di 5 a 10 per ogni campione sperimentale ha prodotto dati con scarsa riproducibilità e variazione alta3. Ciò è probabilmente dovuto l’errore sperimentale associata con estrazione del RNA e l’efficienza di trascrizione inversa. Sequenziamento di RNA è stata eseguita anche utilizzando un unico mouse e ovociti umani4,5. Questa tecnica richiede passaggi di amplificazione del cDNA necessari per la generazione della libreria che probabilmente aumenta la variabilità all’interno di un gruppo sperimentale. Inoltre, trascrizioni di abbondanza bassa possono non essere rilevabile. Anche se i prezzi di sequenziamento sono scesi di ultimi anni, può ancora essere costi proibitivi a causa del costo elevato di analisi bioinformatica. Infine, la localizzazione di mRNA è un processo dinamico con cambiamenti spaziali contribuendo alla proteina funzione6. Pertanto, abbiamo deciso di adottare una tecnica che avrebbe prodotto accurate e riproducibile misure quantitative e localizzazione di singoli mRNA in singoli ovociti.
DNA ramificato accoppiato all’ibridazione fluorescente in situ amplifica il segnale di fluorescenza piuttosto che amplificazione RNA/cDNA abilitazione individuazione dei singoli mRNAs in singole celle 7,8,9. Il dosaggio è effettuato attraverso una serie di ibridazione, amplificazione (usando il DNA ramificato) e fluorescenza etichettatura passi al fine di amplificare il segnale di fluorescenza7. La tecnica comincia con l’associazione di coppie di sonda di 18 – 25-base del oligonucleotide che sono complementari a un specifico mRNA3,8,10. Quindici-venti coppie di sonda sono progettate per ogni specificità assicurando di trascrizione per la trascrizione di destinazione. L’ibridazione di specifici mRNA è seguita dalle sonde preamplificatore e amplificatore che formano una configurazione ramificata. Circa, 400 etichetta fluorofori associare a ciascun amplificatore, conseguente 8000-fold aumento in fluorescenza permettendo la rilevazione di singoli mRNA (Figura 1)11.
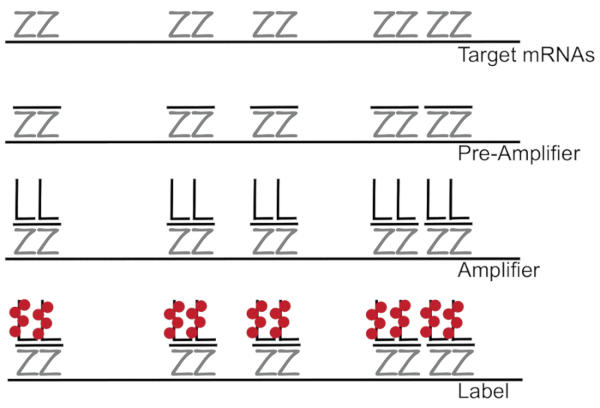
Figura 1: schema del protocollo SM-pesce. Sequenza ibridazione della sonda specifica trascrizione, ramificata amplificatore DNA e fluoroforo ad un target di mRNA viene mostrato. Clicca qui per visualizzare una versione più grande di questa figura.
Gli studi precedenti usando la singola molecola fluorescenza in situ di ibridazione (SM-pesce) localizzato β-actina mRNA in singoli neuroni12 e papillomavirus umano DNA nel cancro cervicale delle cellule linee7. Il software per computer trovare posto e programma di controllo identifica singolo segnale fluorescente punctato ed è stato usato con successo per quantificare il numero dei mRNAs in ogni cella3,13.
Sulla base dei risultati della rilevazione di mRNA in neuroni12, abbiamo supposto che SM-pesce si sarebbe rivelato un utile strumento per quantificare i livelli di trascrizione in murini ovociti ed embrioni tra cui abbondanza bassa mRNAs. Tuttavia, la tecnica è ottimizzata per l’utilizzo con celle fisse aderenti e formaldeide fissata paraffina embedded sezioni di tessuto (FFPE). Gli ovociti non possono aderire a una diapositiva, anche quando essi sono rivestiti con poli-L-lisina. Inoltre, essi sono più fragili di cellule somatiche e sezioni di tessuto con conseguente lisi cellulare quando sottoposto ad alcuni dei buffer proprietarie in kit commercialmente disponibili3. Per superare queste sfide, ovociti erano fissi e trasferiti manualmente tra gocce dei buffer. Inoltre, la permeabilizzazione e wash buffer nei kit sono stati sostituiti per ridurre la lisi delle cellule. Sonde predefiniti vengono acquistati a fianco il kit di pesce o possono essere richiesti specifici trascritti. Ogni set di sonde proprietarie è disponibile in uno dei tre canali di fluorescenza (C1, C2 e C3) per consentire per multiplexing. Nell’esperimento attuale, ovociti murini sono stati doppia colorazione e quantificati mediante una sonda di C2 Nanog e una sonda di C3 Pou5f1 . Queste sonde sono state selezionate basato sull’espressione di Nanog e Pou5f1 segnalato di ovociti ed embrioni. A conclusione delle operazioni di ibridazione, gli ovociti sono stati collocati in gocce di mezzi di montaggio anti-dissolvenza per vetrini istologici dell’applicazione. Immagini confocal sono stati utilizzati per quantificare il numero di segnali fluorescenti punctati che rappresentano singoli mRNA. Oltre a quantificare i mRNAs, formazione immagine ha mostrato anche la distribuzione spaziale di specifici mRNA nella cellula, quali altri metodi di quantificazione di RNA sono in grado di raggiungere. Questa tecnica ha dimostrato di avere bassa variabilità all’interno di un gruppo sperimentale che consente di utilizzare numeri più piccoli degli ovociti in ogni gruppo sperimentale per identificare differenze significative tra i gruppi sperimentali3.
Protocol
Representative Results
Discussion
Una serie di passaggi minore durante il protocollo garantirà successo fluorescenza e conteggi precisi dei mRNAs. In primo luogo, il protocollo deve essere eseguito immediatamente dopo la raccolta e la fissazione degli ovociti. Si noti che il PVP viene aggiunto nel buffer di fissazione del paraformaldeide al 4% per impedire che gli ovociti attaccare a vicenda. Abbiamo trovato che è necessario eseguire l’esperimento immediatamente dopo la raccolta e la fissazione degli ovociti. Qualsiasi ritardo si traduce in un segnale …
Disclosures
The authors have nothing to disclose.
Acknowledgements
Ringraziamo il Dr. Daniel R. Larson per il suo generoso aiuto con l’installazione e l’uso della ricerca di Spot e programma di controllo 13 ed il supporto tecnico di Università del Nebraska Lincoln microscopia Core per l’imaging di microscopia confocale. Questo studio rappresenta un contributo dell’Università di divisione di ricerca agricola di Nebraska, Lincoln, Nebraska ed è stato sostenuto da fondi di tratteggio UNL (NEB-26-206/adesione numero-232435 e NEB-26-231/adesione numero-1013511).
Materials
| (±)-α-Lipoic acid | Sigma-Aldrich | T1395 | Alpha Lipoic Acid |
| Albumin, Bovine Serum, Low Fatty Acid | MP Biomedicals, LLC | 199899 | FAF BSA |
| BD 10mL TB Syringe | Becton, Dickinson and Company | 309659 | 10 mL syringe |
| BD PrecisionGlide Needle | Becton, Dickinson and Company | 305109 | 27 1/2 gauge needle |
| Calcium chloride dihydrate | Sigma-Aldrich | C7902 | CaCl2-2H2O |
| Citric acid | Sigma-Aldrich | C2404 | Citrate |
| D-(+)-Glucose | Sigma-Aldrich | G6152 | Glucose |
| Disodium phosphate | Na2HPO4 | ||
| Easy Grip Petri Dish | Falcon Corning | 351008 | 35 mm dish |
| Edetate Disodium | Avantor | 8994-01 | EDTA |
| Extra Fine Bonn Scissors | Fine Science Tools | 14084-08 | Straight, Sharp/Sharp, non-serrated, 13mm cutting edge scissors |
| Fetal Bovine Serum | Atlanta biologicals | S10250 | FBS |
| Gentamicin Reagent Solution | gibco | 15710-064 | Gentamicin |
| GlutaMAX-I (100X) | gibco | 35050-061 | Glutamax |
| Gold Seal Micro Slides | Gold Seal | 3039 | 25 x 75mm slides |
| Gonadotropin, From Pregnant Mares' Serum | Sigma | G4877 | eCG |
| hCG recombinant | NHPP | AFP8456A | hCG |
| Hyaluronidase, Type IV-S: From Bovine Testes | Sigma-Aldrich | H3884 | Hyaluronidase |
| Jewelers Style Forceps | Integra | 17-305X | Forceps 4-3/8", Style 5F, Straight, Micro Fine Jaw |
| L-(+)-Lactic Acid, free acid | MP Biomedicals, LLC | 190228 | L-Lactate |
| Magnesium sulfate heptahydrate | Sigma-Aldrich | M2773 | MgSO4-7H2O |
| MEM Nonessential Amino Acids | Corning | 25-025-Cl | NEAA |
| Microscope Cover Glass | Fisher Scientific | 12-542-C | 25 x 25x 0.15 mm cover slips |
| Mm-Nanog-O2-C2 RNAscope Probe | Advanced Cell Diagnostics | 501891-C2 | Nanog Probe |
| Mm-Pou5f1-O1-C3 RNAscope Probe | Advanced Cell Diagnostics | 501611-C3 | Pou5f1 Probe |
| MOPS | Sigma-Aldrich | M3183 | |
| Paraformaldehyde | Sigma-Aldrich | P6148 | Paraformaldehyde |
| PES 0.22 um Membrane -sterile | Millex-GP | SLGP033RS | 0.22 um filters |
| Polyvinylpyrrolidone | Sigma-Aldrich | P0930 | PVP |
| Potassium chloride | Sigma-Aldrich | 60128 | KCl |
| Potassium phosphate monobasic | Sigma-Aldrich | 60218 | KH2PO4 |
| Prolong Gold antifade reagent | invitrogen | P36934 | Antifade reagent without DAPI |
| RNAscope DAPI | Advanced Cell Diagnostics | 320858 | DAPI |
| RNAscope FL AMP 1 | Advanced Cell Diagnostics | 320852 | Amplifier 1 |
| RNAscope FL AMP 2 | Advanced Cell Diagnostics | 320853 | Amplifier 2 |
| RNAscope FL AMP 3 | Advanced Cell Diagnostics | 320854 | Amplifier 3 |
| RNAscope FL AMP 4 ALT A | Advanced Cell Diagnostics | 320855 | Amplifier 4 ALT A |
| RNAscope FL AMP 4 ALT B | Advanced Cell Diagnostics | 320856 | Amplifier 4 ALT B |
| RNAscope FL AMP 4 ALT C | Advanced Cell Diagnostics | 320857 | Amplifier 4 ALT C |
| RNAscope Fluorescent Multiplex Detection Reagents Kit | Advanced Cell Diagnostics | 320851 | FISH Reagent Kit |
| RNAscope Probe 3-plex Negative Control Probe | Advanced Cell Diagnostics | 320871 | Negative Control |
| RNAscope Probe 3-plex Positive Control | Advanced Cell Diagnostics | 320881 | Positive Control |
| RNAscope Probe Diluent | Advanced Cell Diagnostics | 300041 | Probe Diluent |
| RNAscope Protease III | Advanced Cell Diagnositics | 322337 | Protease III |
| RNAscope Protease III & IV Reagent Kit | Advanced Cell Diagnostics | 322340 | FISH Protease Kit |
| RNAscope Protease IV | Advanced Cell Diagnostics | 322336 | Protease IV |
| S/S Needle with Luer Hub 30G | Component Supply Co. | NE-301PL-50 | blunt 30 gauge needle |
| Sodium bicarbonate | Sigma-Aldrich | S6297 | NaHCO3 |
| Sodium chloride | Sigma-Aldrich | S6191 | NaCl |
| Sodium hydroxide | Sigma-Aldrich | 306576 | NaOH |
| Sodium pyruvate, >= 99% | Sigma-Aldrich | P5280 | Pyruvate |
| Solution 6 Well Dish | Agtechinc | D18 | 6 well dish |
| Taurine | Sigma-Aldrich | T8691 | Taurine |
| Tissue Culture Dish | Falcon Corning | 353002 | 60 mm dish |
| Triton X-100 | Sigma-Aldrich | X100 | Triton X-100 |
References
- Vogelstein, B., Kinzler, K. W. Digital PCR. Proceedings of the National Academy of Sciences. 96 (16), 9236-9241 (1999).
- MacK, E. M., Smith, J. E., Kurz, S. G., Wood, J. R. CAMP-dependent regulation of ovulatory response genes is amplified by IGF1 due to synergistic effects on Akt phosphorylation and NF-kB transcription factors. Reproduction. 144 (5), 595-602 (2012).
- Xie, F., Timme, K. A., Wood, J. R. Using Single Molecule mRNA Fluorescent in Situ Hybridization (RNA-FISH) to Quantify mRNAs in Individual Murine Oocytes and Embryos. Scientific Reports. 8 (1), 7930 (2018).
- Ruebel, M. L., et al. Obesity modulates inflammation and lipidmetabolism oocyte gene expression: A single-cell transcriptome perspective. Journal of Clinical Endocrinology and Metabolism. 102 (6), 2029-2038 (2017).
- Borensztein, M., Syx, L., Servant, N., Heard, E. . Mouse Oocyte Development. 1818, 51-65 (2018).
- Jansova, D., Tetkova, A., Koncicka, M., Kubelka, M., Susor, A. Localization of RNA and translation in the mammalian oocyte and embryo. PLoS ONE. 13 (3), 1-25 (2018).
- Player, A. N., Shen, L. P., Kenny, D., Antao, V. P., Kolberg, J. A. Single-copy gene detection using branched DNA (bDNA) in situ hybridization. Journal of Histochemistry and Cytochemistry. 49 (5), 603-611 (2001).
- Wang, F., et al. RNAscope: A novel in situ RNA analysis platform for formalin-fixed, paraffin-embedded tissues. Journal of Molecular Diagnostics. 14 (1), 22-29 (2012).
- Itzkovitz, S., van Oudenaarden, A. Validating transcripts with probes and imaging technology. Nature Methods. 8 (4), S12-S19 (2011).
- Derti, A., et al. ProbeDesigner: for the design of probesets for branched DNA (bDNA) signal amplification assays. Bioinformatics. 15 (5), 348-355 (1999).
- Larson, B., Malayter, D., Shure, M. Multiplexed Detection of Cytokine Cancer Biomarkers using Fluorescence RNA In Situ Hybridization and Cellular Imaging. BioTek Application Notes. , 1-5 (2016).
- Buxbaum, A. R., Wu, B., Singer, R. H. Single β-Actin mRNA Detection in Neurons Reveals a Mechanism for Regulating Its Translatability. Science. 343 (6169), 419-422 (2014).
- Thompson, R. E., Larson, D. R., Webb, W. W. Precise nanometer localization analysis for individual fluorescent probes. Biophysical Journal. 82 (5), 2775-2783 (2002).
- Herrick, J. R., Paik, T., Strauss, K. J., Schoolcraft, W. B., Krisher, R. L. Building a better mouse embryo assay: effects of mouse strain and in vitro maturation on sensitivity to contaminants of the culture environment. Journal of Assisted Reproduction and Genetics. 33 (2), 237-245 (2016).
- Pohlmeier, W. E., Xie, F., Kurz, S. G., Lu, N., Wood, J. R. Progressive obesity alters the steroidogenic response to ovulatory stimulation and increases the abundance of mRNAs stored in the ovulated oocyte. Molecular Reproduction and Development. 81 (8), 735-747 (2014).
- Xie, F., Anderson, C. L., Timme, K. R., Kurz, S. G., Fernando, S. C., Wood, J. R. Obesity-dependent increases in oocyte mRNAs are associated with increases in proinflammatory signaling and gut microbial abundance of lachnospiraceae in female mice. Endocrinology. 157 (4), 1630-1643 (2016).
- Hirao, Y., Yanagimachi, R. Detrimental effect of visible light on meiosis of mammalian eggs in vitro. Journal of Experimental Zoology. , (1978).
- Takenaka, M., Horiuchi, T., Yanagimachi, R. Effects of light on development of mammalian zygotes. Proceedings of the National Academy of Sciences. 104 (36), 14293-14293 (2007).
- Komminoth, P., Werner, M. Target and signal amplification: Approaches to increase the sensitivity of in situ hybridization. Histochemistry and Cell Biology. 108 (4-5), 325-333 (1997).
- Hornick, J. E., Duncan, F. E., Shea, L. D., Woodruff, T. K. Multiple follicle culture supports primary follicle growth through paracrine-acting signals. Reproduction. 145 (1), 19-32 (2013).
- Vlasova-St. Louis, I., Bohjanen, P. Feedback Regulation of Kinase Signaling Pathways by AREs and GREs. Cells. 5 (1), 4 (2016).
- Gilbert, C., Svejstrup, J. Q. RNA Immunoprecipitation for Determining RNA-Protein Associations In Vivo. Current Protocols in Molecular Biology. 75 (1), 27.4.1-27.4.11 (2006).
- Kwon, S., Chin, K., Nederlof, M., Gray, J. W. Quantitative, in situ analysis of mRNAs and proteins with subcellular resolution. Scientific Reports. 7 (1), 16459 (2017).
- Voigt, F., et al. Single-Molecule Quantification of Translation-Dependent Association of mRNAs with the Endoplasmic Reticulum. Cell Reports. 21 (13), 3740-3753 (2017).
- Halstead, J. M., Wilbertz, J. H., Wippich, F., Lionnet, T., Ephrussi, A., Chao, J. A. TRICK: A Single-Molecule Method for Imaging the First Round of Translation in Living Cells and Animals. Methods in Enzymology. 572, (2016).
- Cookson, W., Liang, L., Abecasis, G., Moffatt, M., Lathrop, M. Mapping complex disease traits with global gene expression. Nature Reviews Genetics. 10 (3), 184-194 (2009).
- Houle, D., Govindaraju, D. R., Omholt, S. Phenomics: the next challenge. Nature Reviews Genetics. 11, 855 (2010).
- Freimer, N., Sabatti, C. The Human Phenome Project. Nature Genetics. 34, 15 (2003).

