Uso de uma única molécula fluorescente hibridação In Situ (FISH-SM) para Quantify e Localize os mRNAs em oócitos murino
Summary
Para reproducibly contar os números dos mRNAs em oócitos individuais, fluorescência única molécula de RNA in situ hibridação (RNA-FISH) foi otimizada para células não-aderentes. Oócitos foram coletados, hibridizados com sondas específicas transcrição e quantificados usando um software de quantificação de imagem.
Abstract
Métodos atuais rotineiramente usados para quantificar o mRNA de oócitos e embriões incluem digital polimerase transcrição reversa reação em cadeia (dPCR), quantitativo, real-time RT-PCR (RT-qPCR) e sequenciação do ARN. Quando estas técnicas são realizadas usando um único oócito ou embrião, baixo-cópia mRNAs confiável não são detectados. Para superar este problema, oócitos ou embriões podem ser agrupados para análise; no entanto, isso muitas vezes leva a alta variabilidade entre as amostras. Neste protocolo, descrevemos o uso da fluorescência hibridação in situ (FISH) usando química de DNA ramificada. Esta técnica identifica o padrão espacial dos mRNAs em células individuais. Quando a técnica está associada a encontrar o local e software de computador de rastreamento, a abundância de mRNAs na célula também pode ser quantificada. Usando esta técnica, há reduzida variabilidade dentro de um grupo experimental e menos oócitos e embriões são necessários para detectar diferenças significativas entre os grupos experimentais. Comercialmente disponível DNA ramificado SM-kits de peixes foram otimizados para detectar mRNAs em secionado tecidos ou células aderentes em slides. No entanto, oócitos efetivamente não adere aos slides e alguns reagentes do kit foram muito duras, resultando em lise do oócito. Para evitar este Lise, várias modificações foram feitas para o kit de peixe. Especificamente, buffers de permeabilização e lavagem de oócito projetados para a imunofluorescência de oócitos e embriões substituiu os buffers de proprietários. A permeabilização, lavagens e incubação com sondas e amplificador foram realizadas em placas de 6-poços e oócitos foram colocados em slides no final do protocolo utilizando meios de montagem. Essas modificações foram capazes de superar as limitações do kit comercialmente disponível, em particular, a lise do oócito. Para precisão e reproducibly contar o número dos mRNAs em oócitos individuais, utilizou-se o software de computador. Juntos, este protocolo representa uma alternativa para PCR e sequenciamento para comparar a expressão de transcritos específicos em células únicas.
Introduction
Transcriptase reversa cadeia da polimerase (PCR) tem sido o padrão-ouro para quantificação de mRNA. Dois ensaios, digital PCR (dPCR)1 e quantitativo, real time PCR (qPCR)2 são utilizados atualmente. Das duas técnicas de PCR, dPCR tem maior sensibilidade do que qPCR, sugerindo que poderia ser usado para medir a abundância de mRNA em células únicas. No entanto, em nossas mãos, dPCR análise de mRNAs baixa abundância nas piscinas de ovócitos de 5 a 10 por cada amostra experimental produziu dados com baixa reprodutibilidade e alta variação3. Isto é provavelmente devido ao erro experimental associado a extração do RNA e transcrição reversa eficiência. A sequenciação do ARN também foi executada usando um único rato e oócitos humanos4,5. Esta técnica requer etapas de amplificação do cDNA necessárias para a geração de biblioteca que provavelmente aumenta a variabilidade dentro de um grupo experimental. Além disso, transcrições de baixa abundância podem não ser detectáveis. Embora os preços de sequenciamento caíram nos últimos anos, ainda pode ser custo proibitivo devido ao alto custo das análises de Bioinformática. Finalmente, a localização de mRNA é um processo dinâmico, com alterações espaciais, contribuindo para a proteína função6. Portanto, decidimos para adotar uma técnica que produziria medidas quantitativas precisas e reprodutíveis e localização dos mRNAs individuais em oócitos único.
DNA em cadeia ramificada acoplado a fluorescência hibridação in situ amplifica o sinal de fluorescência em vez de amplificação do RNA/cDNA permita deteção dos mRNAs único em células individuais 7,8,9. O ensaio é realizado através de uma série de hibridização e amplificação (usando DNA em cadeia ramificada) fluorescência rotulagem passos a fim de amplificar o sinal de fluorescência7. A técnica começa com ligação de pares de sonda de 18 a 25-base do oligonucleotide que são complementares a uma específica do mRNA3,8,10. Quinze a vinte pares de sonda são projetados para cada especificidade de transcrição garantindo para a transcrição do alvo. A hibridação de mRNA específico é seguida por sondas pré-amplificador e amplificador que formam uma configuração ramificada. Aproximadamente, 400 rótulo fluorophores bind para cada amplificador, resultando em um 8000-fold aumento na fluorescência permitindo a deteção de mRNAs individuais (Figura 1)11.
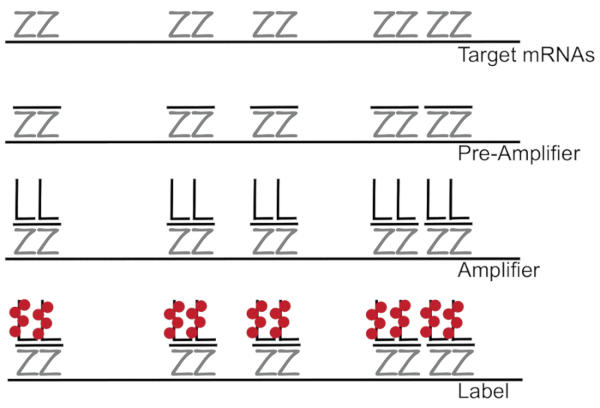
Figura 1: esquemático do protocolo SM-peixes. Sequencial hibridização da sonda específica de transcrição, ramificado DNA amplificador e fluoróforo para um destino de mRNA é mostrado. Clique aqui para ver uma versão maior desta figura.
Estudos anteriores usando fluorescência única molécula em situ da hibridação (SM-peixe) localizada β-actina mRNAs em neurônios individuais12 e DNA de papilomavírus humano em câncer de colo uterino de células linhas7. O software de computador, encontrar o local e o programa de rastreamento identifica o sinal fluorescente punctate individual e tem sido usada com sucesso para quantificar o número de mRNAs em cada célula3,13.
Baseado nos resultados da deteção do mRNA em neurônios12, formulamos a hipótese que SM-peixe provaria uma ferramenta útil para dosar os níveis de transcrição de murino oócitos e embriões, incluindo baixa abundância mRNAs. No entanto, a técnica é otimizada para uso com pilhas fixos aderentes e formaldeído fixada parafina incorporado cortes de tecido (FFPE). Oócitos não podem aderir a um slide, mesmo quando eles são revestidos com poli-L-lisina. Além disso, eles são mais frágeis do que as células somáticas e cortes de tecido, resultando em lise celular quando submetido a alguns dos buffers de proprietários em kits comercialmente disponíveis3. Para superar estes desafios, oócitos foram fixo e manualmente transferidos entre gotas dos buffers. Além disso, os buffers de permeabilização e lavagem nos kits foram substituídos para reduzir o lysis da pilha. Sondas preconcebidas são compradas juntamente com o kit de peixe ou transcrições específicas podem ser solicitadas. Cada conjunto de sonda proprietário está disponível em um dos três canais de fluorescência (C1, C2 e C3) para permitir a multiplexação. Na experiência atual, murino oócitos foram manchadas de dual e quantificados usando uma sonda de C2 Nanog e uma sonda de C3 Pou5f1 . Estas sondas foram selecionadas com base em expressão relatado de Nanog e Pou5f1 de oócitos e embriões. Na conclusão das etapas da hibridação, oócitos foram colocados em gotas de mídia anti-desvaneça-se montagem para aplicação de lâminas histológicas. Confocal imagens foram usadas para quantificar o número de sinais fluorescentes punctate que representam os mRNAs individuais. Além de quantificar os mRNAs, imagem também mostrou a distribuição espacial do mRNA específico na célula, quais outros métodos de quantificação de RNA são incapazes de alcançar. Esta técnica provou ter baixa variabilidade dentro de um grupo experimental, permitindo o uso de um menor número de oócitos em cada grupo experimental para identificar diferenças significativas entre os grupos experimentais3.
Protocol
Representative Results
Discussion
Uma série de pequenas etapas durante o protocolo irá garantir sucesso fluorescência e contagens exatas dos mRNAs. Em primeiro lugar, o protocolo deve ser realizado imediatamente após a coleta e fixação de oócitos. Observe que o PVP é adicionado para o buffer de fixação paraformaldeído 4% para evitar oócitos grudem uns aos outros. Nós achamos que é necessário realizar o experimento imediatamente após a coleta e fixação de oócitos. Qualquer atraso resulta em um muito menor sinal de fluorescência que res…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Agradecemos o Dr. Daniel R. Larson por sua generosa ajuda com a instalação e utilização do local encontrando e programa de rastreamento 13 e o apoio técnico da Universidade de Nebraska Lincoln microscopia núcleo para a imagem de microscopia confocal. Este estudo representa uma contribuição da Universidade da divisão de pesquisa agrícola de Nebraska, Lincoln, Nebraska e foi apoiado por fundos de hachura UNL (NEB-26-206/adesão número-232435 e NEB-26-231/adesão número-1013511).
Materials
| (±)-α-Lipoic acid | Sigma-Aldrich | T1395 | Alpha Lipoic Acid |
| Albumin, Bovine Serum, Low Fatty Acid | MP Biomedicals, LLC | 199899 | FAF BSA |
| BD 10mL TB Syringe | Becton, Dickinson and Company | 309659 | 10 mL syringe |
| BD PrecisionGlide Needle | Becton, Dickinson and Company | 305109 | 27 1/2 gauge needle |
| Calcium chloride dihydrate | Sigma-Aldrich | C7902 | CaCl2-2H2O |
| Citric acid | Sigma-Aldrich | C2404 | Citrate |
| D-(+)-Glucose | Sigma-Aldrich | G6152 | Glucose |
| Disodium phosphate | Na2HPO4 | ||
| Easy Grip Petri Dish | Falcon Corning | 351008 | 35 mm dish |
| Edetate Disodium | Avantor | 8994-01 | EDTA |
| Extra Fine Bonn Scissors | Fine Science Tools | 14084-08 | Straight, Sharp/Sharp, non-serrated, 13mm cutting edge scissors |
| Fetal Bovine Serum | Atlanta biologicals | S10250 | FBS |
| Gentamicin Reagent Solution | gibco | 15710-064 | Gentamicin |
| GlutaMAX-I (100X) | gibco | 35050-061 | Glutamax |
| Gold Seal Micro Slides | Gold Seal | 3039 | 25 x 75mm slides |
| Gonadotropin, From Pregnant Mares' Serum | Sigma | G4877 | eCG |
| hCG recombinant | NHPP | AFP8456A | hCG |
| Hyaluronidase, Type IV-S: From Bovine Testes | Sigma-Aldrich | H3884 | Hyaluronidase |
| Jewelers Style Forceps | Integra | 17-305X | Forceps 4-3/8", Style 5F, Straight, Micro Fine Jaw |
| L-(+)-Lactic Acid, free acid | MP Biomedicals, LLC | 190228 | L-Lactate |
| Magnesium sulfate heptahydrate | Sigma-Aldrich | M2773 | MgSO4-7H2O |
| MEM Nonessential Amino Acids | Corning | 25-025-Cl | NEAA |
| Microscope Cover Glass | Fisher Scientific | 12-542-C | 25 x 25x 0.15 mm cover slips |
| Mm-Nanog-O2-C2 RNAscope Probe | Advanced Cell Diagnostics | 501891-C2 | Nanog Probe |
| Mm-Pou5f1-O1-C3 RNAscope Probe | Advanced Cell Diagnostics | 501611-C3 | Pou5f1 Probe |
| MOPS | Sigma-Aldrich | M3183 | |
| Paraformaldehyde | Sigma-Aldrich | P6148 | Paraformaldehyde |
| PES 0.22 um Membrane -sterile | Millex-GP | SLGP033RS | 0.22 um filters |
| Polyvinylpyrrolidone | Sigma-Aldrich | P0930 | PVP |
| Potassium chloride | Sigma-Aldrich | 60128 | KCl |
| Potassium phosphate monobasic | Sigma-Aldrich | 60218 | KH2PO4 |
| Prolong Gold antifade reagent | invitrogen | P36934 | Antifade reagent without DAPI |
| RNAscope DAPI | Advanced Cell Diagnostics | 320858 | DAPI |
| RNAscope FL AMP 1 | Advanced Cell Diagnostics | 320852 | Amplifier 1 |
| RNAscope FL AMP 2 | Advanced Cell Diagnostics | 320853 | Amplifier 2 |
| RNAscope FL AMP 3 | Advanced Cell Diagnostics | 320854 | Amplifier 3 |
| RNAscope FL AMP 4 ALT A | Advanced Cell Diagnostics | 320855 | Amplifier 4 ALT A |
| RNAscope FL AMP 4 ALT B | Advanced Cell Diagnostics | 320856 | Amplifier 4 ALT B |
| RNAscope FL AMP 4 ALT C | Advanced Cell Diagnostics | 320857 | Amplifier 4 ALT C |
| RNAscope Fluorescent Multiplex Detection Reagents Kit | Advanced Cell Diagnostics | 320851 | FISH Reagent Kit |
| RNAscope Probe 3-plex Negative Control Probe | Advanced Cell Diagnostics | 320871 | Negative Control |
| RNAscope Probe 3-plex Positive Control | Advanced Cell Diagnostics | 320881 | Positive Control |
| RNAscope Probe Diluent | Advanced Cell Diagnostics | 300041 | Probe Diluent |
| RNAscope Protease III | Advanced Cell Diagnositics | 322337 | Protease III |
| RNAscope Protease III & IV Reagent Kit | Advanced Cell Diagnostics | 322340 | FISH Protease Kit |
| RNAscope Protease IV | Advanced Cell Diagnostics | 322336 | Protease IV |
| S/S Needle with Luer Hub 30G | Component Supply Co. | NE-301PL-50 | blunt 30 gauge needle |
| Sodium bicarbonate | Sigma-Aldrich | S6297 | NaHCO3 |
| Sodium chloride | Sigma-Aldrich | S6191 | NaCl |
| Sodium hydroxide | Sigma-Aldrich | 306576 | NaOH |
| Sodium pyruvate, >= 99% | Sigma-Aldrich | P5280 | Pyruvate |
| Solution 6 Well Dish | Agtechinc | D18 | 6 well dish |
| Taurine | Sigma-Aldrich | T8691 | Taurine |
| Tissue Culture Dish | Falcon Corning | 353002 | 60 mm dish |
| Triton X-100 | Sigma-Aldrich | X100 | Triton X-100 |
References
- Vogelstein, B., Kinzler, K. W. Digital PCR. Proceedings of the National Academy of Sciences. 96 (16), 9236-9241 (1999).
- MacK, E. M., Smith, J. E., Kurz, S. G., Wood, J. R. CAMP-dependent regulation of ovulatory response genes is amplified by IGF1 due to synergistic effects on Akt phosphorylation and NF-kB transcription factors. Reproduction. 144 (5), 595-602 (2012).
- Xie, F., Timme, K. A., Wood, J. R. Using Single Molecule mRNA Fluorescent in Situ Hybridization (RNA-FISH) to Quantify mRNAs in Individual Murine Oocytes and Embryos. Scientific Reports. 8 (1), 7930 (2018).
- Ruebel, M. L., et al. Obesity modulates inflammation and lipidmetabolism oocyte gene expression: A single-cell transcriptome perspective. Journal of Clinical Endocrinology and Metabolism. 102 (6), 2029-2038 (2017).
- Borensztein, M., Syx, L., Servant, N., Heard, E. . Mouse Oocyte Development. 1818, 51-65 (2018).
- Jansova, D., Tetkova, A., Koncicka, M., Kubelka, M., Susor, A. Localization of RNA and translation in the mammalian oocyte and embryo. PLoS ONE. 13 (3), 1-25 (2018).
- Player, A. N., Shen, L. P., Kenny, D., Antao, V. P., Kolberg, J. A. Single-copy gene detection using branched DNA (bDNA) in situ hybridization. Journal of Histochemistry and Cytochemistry. 49 (5), 603-611 (2001).
- Wang, F., et al. RNAscope: A novel in situ RNA analysis platform for formalin-fixed, paraffin-embedded tissues. Journal of Molecular Diagnostics. 14 (1), 22-29 (2012).
- Itzkovitz, S., van Oudenaarden, A. Validating transcripts with probes and imaging technology. Nature Methods. 8 (4), S12-S19 (2011).
- Derti, A., et al. ProbeDesigner: for the design of probesets for branched DNA (bDNA) signal amplification assays. Bioinformatics. 15 (5), 348-355 (1999).
- Larson, B., Malayter, D., Shure, M. Multiplexed Detection of Cytokine Cancer Biomarkers using Fluorescence RNA In Situ Hybridization and Cellular Imaging. BioTek Application Notes. , 1-5 (2016).
- Buxbaum, A. R., Wu, B., Singer, R. H. Single β-Actin mRNA Detection in Neurons Reveals a Mechanism for Regulating Its Translatability. Science. 343 (6169), 419-422 (2014).
- Thompson, R. E., Larson, D. R., Webb, W. W. Precise nanometer localization analysis for individual fluorescent probes. Biophysical Journal. 82 (5), 2775-2783 (2002).
- Herrick, J. R., Paik, T., Strauss, K. J., Schoolcraft, W. B., Krisher, R. L. Building a better mouse embryo assay: effects of mouse strain and in vitro maturation on sensitivity to contaminants of the culture environment. Journal of Assisted Reproduction and Genetics. 33 (2), 237-245 (2016).
- Pohlmeier, W. E., Xie, F., Kurz, S. G., Lu, N., Wood, J. R. Progressive obesity alters the steroidogenic response to ovulatory stimulation and increases the abundance of mRNAs stored in the ovulated oocyte. Molecular Reproduction and Development. 81 (8), 735-747 (2014).
- Xie, F., Anderson, C. L., Timme, K. R., Kurz, S. G., Fernando, S. C., Wood, J. R. Obesity-dependent increases in oocyte mRNAs are associated with increases in proinflammatory signaling and gut microbial abundance of lachnospiraceae in female mice. Endocrinology. 157 (4), 1630-1643 (2016).
- Hirao, Y., Yanagimachi, R. Detrimental effect of visible light on meiosis of mammalian eggs in vitro. Journal of Experimental Zoology. , (1978).
- Takenaka, M., Horiuchi, T., Yanagimachi, R. Effects of light on development of mammalian zygotes. Proceedings of the National Academy of Sciences. 104 (36), 14293-14293 (2007).
- Komminoth, P., Werner, M. Target and signal amplification: Approaches to increase the sensitivity of in situ hybridization. Histochemistry and Cell Biology. 108 (4-5), 325-333 (1997).
- Hornick, J. E., Duncan, F. E., Shea, L. D., Woodruff, T. K. Multiple follicle culture supports primary follicle growth through paracrine-acting signals. Reproduction. 145 (1), 19-32 (2013).
- Vlasova-St. Louis, I., Bohjanen, P. Feedback Regulation of Kinase Signaling Pathways by AREs and GREs. Cells. 5 (1), 4 (2016).
- Gilbert, C., Svejstrup, J. Q. RNA Immunoprecipitation for Determining RNA-Protein Associations In Vivo. Current Protocols in Molecular Biology. 75 (1), 27.4.1-27.4.11 (2006).
- Kwon, S., Chin, K., Nederlof, M., Gray, J. W. Quantitative, in situ analysis of mRNAs and proteins with subcellular resolution. Scientific Reports. 7 (1), 16459 (2017).
- Voigt, F., et al. Single-Molecule Quantification of Translation-Dependent Association of mRNAs with the Endoplasmic Reticulum. Cell Reports. 21 (13), 3740-3753 (2017).
- Halstead, J. M., Wilbertz, J. H., Wippich, F., Lionnet, T., Ephrussi, A., Chao, J. A. TRICK: A Single-Molecule Method for Imaging the First Round of Translation in Living Cells and Animals. Methods in Enzymology. 572, (2016).
- Cookson, W., Liang, L., Abecasis, G., Moffatt, M., Lathrop, M. Mapping complex disease traits with global gene expression. Nature Reviews Genetics. 10 (3), 184-194 (2009).
- Houle, D., Govindaraju, D. R., Omholt, S. Phenomics: the next challenge. Nature Reviews Genetics. 11, 855 (2010).
- Freimer, N., Sabatti, C. The Human Phenome Project. Nature Genetics. 34, 15 (2003).

