Uso de la sola molécula fluorescente en Situ del hibridación (SM-pescado) para cuantificar y Localize mRNAs en oocitos murinos
Summary
Reproducible, contar los números de los mRNAs de los ovocitos, in situ de la fluorescencia de una molécula de RNA hibridación (RNA-pescado) fue optimizado para las células no adherentes. Ovocitos se recolectaron, cruzado por hibridación con las sondas específicas de transcripción y cuantificaron utilizando un software de cuantificación de la imagen.
Abstract
Métodos actuales que utiliza habitualmente para cuantificar el mRNA en ovocitos y embriones incluyen la reacción en cadena de polimerasa de transcripción inversa digital (dPCR), cuantitativo, en tiempo real RT-PCR (RT-qPCR) y la secuencia de RNA. Cuando estas técnicas se realizan con un solo óvulo o embrión, copia baja mRNAs no se detectan confiablemente. Para superar este problema, ovocitos o embriones pueden se agruparon para el análisis; sin embargo, esto conduce a menudo a la alta variabilidad entre las muestras. En este protocolo, describimos el uso de hibridación fluorescente in situ (FISH) usando química de DNA ramificado. Esta técnica identifica el patrón espacial de mRNAs en células individuales. Cuando la técnica es encontrar lugar y seguimiento informático, también puede cuantificar la abundancia de mRNAs en la célula. Usando esta técnica, hay menor variabilidad dentro de un grupo experimental y se requieren menos ovocitos y embriones para detectar diferencias significativas entre los grupos experimentales. Comercialmente disponible DNA ramificado SM-kits de peces han sido optimizados para detectar mRNAs en tejidos seccionados o células adherentes en diapositivas. Sin embargo, ovocitos no eficazmente a diapositivas y algunos reactivos en el kit eran demasiado duros, resultando en lisis de ovocitos. Para evitar esta lisis, se hicieron varias modificaciones al kit de pescado. Específicamente, buffers de permeabilización y lavado de ovocitos diseñadas para la inmunofluorescencia de oocitos y embriones reemplazados los almacenadores intermediarios del propietarios. La permeabilización, lavados e incubaciones con amplificador y puntas de prueba fueron realizadas en placas de 6 pocillos y ovocitos fueron colocados en portaobjetos en el extremo del protocolo utilizando medios de montaje. Estas modificaciones fueron capaces de superar las limitaciones del kit disponible comercialmente, en particular, la lisis de ovocitos. Precisa y reproducible, contar el número de los mRNAs de los ovocitos, se utilizó el software de computadora. Juntos, este protocolo representa una alternativa a la PCR y secuenciación para comparar la expresión de las transcripciones específicas en las células.
Introduction
Reacción en cadena reversa-transcriptase de polimerasa (PCR) ha sido el estándar de oro para la cuantificación del mRNA. Actualmente se utilizan dos ensayos PCR (dPCR) digital1 y cuantitativa, real time PCR (qPCR)2 . De las dos técnicas PCR, dPCR tiene mayor sensibilidad que la qPCR sugiriendo que podría ser utilizado para medir la abundancia de ARNm en células individuales. Sin embargo, en nuestras manos, análisis de dPCR de mRNAs de baja abundancia en grupos de 5 a 10 ovocitos por cada muestra experimental ha producido datos con baja reproducibilidad y alta variación3. Esto es probablemente debido al error experimental asociado a la extracción de RNA y transcripción reversa eficiencia. La secuencia de RNA también se ha realizado utilizando un único ratón y ovocitos humanos4,5. Esta técnica requiere pasos de amplificación de cDNA para la generación de biblioteca que probablemente aumenta la variabilidad dentro de un grupo experimental. Además, las transcripciones de baja abundancia no pueden ser detectables. Aunque los precios de la secuencia han bajado en los últimos años, todavía puede ser prohibitivo debido al costo alto de Bioinformática análisis de costo. Por último, la localización de mRNA es un proceso dinámico con cambios espaciales que contribuyen a la función de la proteína6. Por lo tanto, nos propusimos adoptar una técnica que produciría medidas cuantitativas precisas y reproducibles y localización de los mRNAs individuales en ovocitos solo.
DNA ramificado juntada a hibridación fluorescente in situ amplifica la señal de fluorescencia en lugar de amplificar RNA/cDNA que permite detección de mRNAs individuales en células individuales 7,8,9. El ensayo se realiza a través de una serie de hibridación, amplificación (usando ADN ramificado) y fluorescencia de etiquetado pasos para amplificar la señal de la fluorescencia del7. La técnica comienza con el atascamiento de pares de sonda de 18 – 25 base de oligonucleótidos que son complementarias a un ARNm específico3,8,10. Quince a veinte pares de sonda están diseñados para cada especificidad asegurando de transcripción para la transcripción de destino. La hibridación específica del mRNA es seguida por sondas de preamplificador y amplificador que forman una configuración ramificada. Aproximadamente, 400 etiqueta fluoróforos se unen a cada amplificador, resultando en un 8000-fold incremento de fluorescencia que permite la detección de mRNAs individuales (figura 1)11.
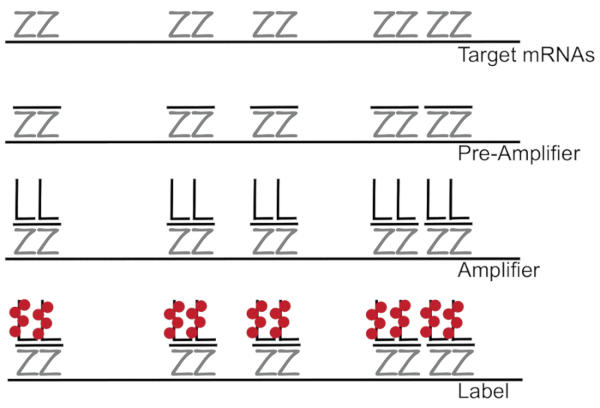
Figura 1: esquema del protocolo SM-pescado. Hibridación secuencial de sonda específica de la transcripción, ramificado ADN amplificador y fluoróforo a un mRNA se muestra de destino. Haga clic aquí para ver una versión más grande de esta figura.
Estudios previos usando in situ hibridación (SM-pescado) localizado β-actina mRNAs en neuronas individuales12 y papillomavirus humano DNA en cáncer de cuello uterino fluorescencia sola molécula célula líneas7. El software de computadora encontrar lugar y programa de seguimiento identifica la señal fluorescente punteada individual y se ha utilizado con éxito para cuantificar el número de mRNAs en cada célula3,13.
Basado en los resultados de la detección de mRNA en las neuronas12, presumimos que SM-pez sería una herramienta útil para cuantificar los niveles de transcripción en murinos ovocitos y embriones incluyendo mRNAs de baja abundancia. Sin embargo, la técnica está optimizada para el uso con las células fijas adherentes y formaldehído fijada parafina incorporado secciones de tejido (FFPE). Ovocitos no se adhieren a un portaobjetos, incluso cuando están recubiertos con poli-l-lisina. Además, son más frágiles que las células somáticas y las secciones de tejido que resulta en lisis celular cuando se someten a algunos de los buffers propietarios en kits disponibles en el mercado3. Para superar estos desafíos, ovocitos fueron fijos y transferidos manualmente entre las gotas de los amortiguadores. Además, buffers de permeabilización y lavado en los kits fueron substituidos para reducir la lisis celular. Sondas prediseñadas se compran junto con el kit de peces o pueden solicitar transcripciones específicas. Cada conjunto de sonda patentada está disponible en uno de los tres canales de fluorescencia (C1, C2 y C3) para permitir la multiplexación. En el experimento actual, oocitos murinos fueron cuantificados utilizando una sonda C2 Nanog y una sonda de C3 Pou5f1 y doble tinción. Estas sondas se seleccionaron con base en la expresión divulgada de Nanog y Pou5f1 en ovocitos y embriones. En la conclusión de los pasos de hibridación, ovocitos fueron colocados en gotas anti-fade del medio de montaje para aplicación a las diapositivas histológicas. Imágenes confocales fueron utilizados para cuantificar el número de señales fluorescentes punteadas que representan los mRNAs. Además de cuantificar los mRNAs, proyección de imagen demostró también la distribución espacial de los mRNA específicas en la célula, que otros métodos de cuantificación de RNA son incapaces de lograr. Esta técnica demostró para tener poca variabilidad dentro de un grupo experimental que permite el uso de un número menor de ovocitos en cada grupo experimental para identificar diferencias significativas entre grupos experimentales3.
Protocol
Representative Results
Discussion
Una serie de pasos pequeños durante el protocolo asegurará de fluorescencia exitosa y precisa de mRNAs. En primer lugar, el protocolo debe realizarse inmediatamente después de recogida y fijación de los ovocitos. Tenga en cuenta que PVP se ha agregado el buffer de fijación de paraformaldehído al 4% para evitar que los ovocitos se pegue uno al otro. Encontramos que es necesario realizar el experimento inmediatamente después de la recogida y fijación de los ovocitos. Cualquier retraso se traduce en una mucho menor …
Disclosures
The authors have nothing to disclose.
Acknowledgements
Agradecemos a Dr. Daniel R. Larson por su generosa ayuda con la instalación y uso del programa de seguimiento y encontrar lugar 13 y el apoyo técnico de la Universidad de Nebraska Lincoln microscopia base para la proyección de imagen de microscopía confocal. Este estudio representa una contribución de la Universidad de la división de investigación agrícola de Nebraska, Lincoln, Nebraska y fue apoyado por fondos de la portilla de UNL (NEB-26-206/número de-232435 y NEB-26-231/número de-1013511).
Materials
| (±)-α-Lipoic acid | Sigma-Aldrich | T1395 | Alpha Lipoic Acid |
| Albumin, Bovine Serum, Low Fatty Acid | MP Biomedicals, LLC | 199899 | FAF BSA |
| BD 10mL TB Syringe | Becton, Dickinson and Company | 309659 | 10 mL syringe |
| BD PrecisionGlide Needle | Becton, Dickinson and Company | 305109 | 27 1/2 gauge needle |
| Calcium chloride dihydrate | Sigma-Aldrich | C7902 | CaCl2-2H2O |
| Citric acid | Sigma-Aldrich | C2404 | Citrate |
| D-(+)-Glucose | Sigma-Aldrich | G6152 | Glucose |
| Disodium phosphate | Na2HPO4 | ||
| Easy Grip Petri Dish | Falcon Corning | 351008 | 35 mm dish |
| Edetate Disodium | Avantor | 8994-01 | EDTA |
| Extra Fine Bonn Scissors | Fine Science Tools | 14084-08 | Straight, Sharp/Sharp, non-serrated, 13mm cutting edge scissors |
| Fetal Bovine Serum | Atlanta biologicals | S10250 | FBS |
| Gentamicin Reagent Solution | gibco | 15710-064 | Gentamicin |
| GlutaMAX-I (100X) | gibco | 35050-061 | Glutamax |
| Gold Seal Micro Slides | Gold Seal | 3039 | 25 x 75mm slides |
| Gonadotropin, From Pregnant Mares' Serum | Sigma | G4877 | eCG |
| hCG recombinant | NHPP | AFP8456A | hCG |
| Hyaluronidase, Type IV-S: From Bovine Testes | Sigma-Aldrich | H3884 | Hyaluronidase |
| Jewelers Style Forceps | Integra | 17-305X | Forceps 4-3/8", Style 5F, Straight, Micro Fine Jaw |
| L-(+)-Lactic Acid, free acid | MP Biomedicals, LLC | 190228 | L-Lactate |
| Magnesium sulfate heptahydrate | Sigma-Aldrich | M2773 | MgSO4-7H2O |
| MEM Nonessential Amino Acids | Corning | 25-025-Cl | NEAA |
| Microscope Cover Glass | Fisher Scientific | 12-542-C | 25 x 25x 0.15 mm cover slips |
| Mm-Nanog-O2-C2 RNAscope Probe | Advanced Cell Diagnostics | 501891-C2 | Nanog Probe |
| Mm-Pou5f1-O1-C3 RNAscope Probe | Advanced Cell Diagnostics | 501611-C3 | Pou5f1 Probe |
| MOPS | Sigma-Aldrich | M3183 | |
| Paraformaldehyde | Sigma-Aldrich | P6148 | Paraformaldehyde |
| PES 0.22 um Membrane -sterile | Millex-GP | SLGP033RS | 0.22 um filters |
| Polyvinylpyrrolidone | Sigma-Aldrich | P0930 | PVP |
| Potassium chloride | Sigma-Aldrich | 60128 | KCl |
| Potassium phosphate monobasic | Sigma-Aldrich | 60218 | KH2PO4 |
| Prolong Gold antifade reagent | invitrogen | P36934 | Antifade reagent without DAPI |
| RNAscope DAPI | Advanced Cell Diagnostics | 320858 | DAPI |
| RNAscope FL AMP 1 | Advanced Cell Diagnostics | 320852 | Amplifier 1 |
| RNAscope FL AMP 2 | Advanced Cell Diagnostics | 320853 | Amplifier 2 |
| RNAscope FL AMP 3 | Advanced Cell Diagnostics | 320854 | Amplifier 3 |
| RNAscope FL AMP 4 ALT A | Advanced Cell Diagnostics | 320855 | Amplifier 4 ALT A |
| RNAscope FL AMP 4 ALT B | Advanced Cell Diagnostics | 320856 | Amplifier 4 ALT B |
| RNAscope FL AMP 4 ALT C | Advanced Cell Diagnostics | 320857 | Amplifier 4 ALT C |
| RNAscope Fluorescent Multiplex Detection Reagents Kit | Advanced Cell Diagnostics | 320851 | FISH Reagent Kit |
| RNAscope Probe 3-plex Negative Control Probe | Advanced Cell Diagnostics | 320871 | Negative Control |
| RNAscope Probe 3-plex Positive Control | Advanced Cell Diagnostics | 320881 | Positive Control |
| RNAscope Probe Diluent | Advanced Cell Diagnostics | 300041 | Probe Diluent |
| RNAscope Protease III | Advanced Cell Diagnositics | 322337 | Protease III |
| RNAscope Protease III & IV Reagent Kit | Advanced Cell Diagnostics | 322340 | FISH Protease Kit |
| RNAscope Protease IV | Advanced Cell Diagnostics | 322336 | Protease IV |
| S/S Needle with Luer Hub 30G | Component Supply Co. | NE-301PL-50 | blunt 30 gauge needle |
| Sodium bicarbonate | Sigma-Aldrich | S6297 | NaHCO3 |
| Sodium chloride | Sigma-Aldrich | S6191 | NaCl |
| Sodium hydroxide | Sigma-Aldrich | 306576 | NaOH |
| Sodium pyruvate, >= 99% | Sigma-Aldrich | P5280 | Pyruvate |
| Solution 6 Well Dish | Agtechinc | D18 | 6 well dish |
| Taurine | Sigma-Aldrich | T8691 | Taurine |
| Tissue Culture Dish | Falcon Corning | 353002 | 60 mm dish |
| Triton X-100 | Sigma-Aldrich | X100 | Triton X-100 |
References
- Vogelstein, B., Kinzler, K. W. Digital PCR. Proceedings of the National Academy of Sciences. 96 (16), 9236-9241 (1999).
- MacK, E. M., Smith, J. E., Kurz, S. G., Wood, J. R. CAMP-dependent regulation of ovulatory response genes is amplified by IGF1 due to synergistic effects on Akt phosphorylation and NF-kB transcription factors. Reproduction. 144 (5), 595-602 (2012).
- Xie, F., Timme, K. A., Wood, J. R. Using Single Molecule mRNA Fluorescent in Situ Hybridization (RNA-FISH) to Quantify mRNAs in Individual Murine Oocytes and Embryos. Scientific Reports. 8 (1), 7930 (2018).
- Ruebel, M. L., et al. Obesity modulates inflammation and lipidmetabolism oocyte gene expression: A single-cell transcriptome perspective. Journal of Clinical Endocrinology and Metabolism. 102 (6), 2029-2038 (2017).
- Borensztein, M., Syx, L., Servant, N., Heard, E. . Mouse Oocyte Development. 1818, 51-65 (2018).
- Jansova, D., Tetkova, A., Koncicka, M., Kubelka, M., Susor, A. Localization of RNA and translation in the mammalian oocyte and embryo. PLoS ONE. 13 (3), 1-25 (2018).
- Player, A. N., Shen, L. P., Kenny, D., Antao, V. P., Kolberg, J. A. Single-copy gene detection using branched DNA (bDNA) in situ hybridization. Journal of Histochemistry and Cytochemistry. 49 (5), 603-611 (2001).
- Wang, F., et al. RNAscope: A novel in situ RNA analysis platform for formalin-fixed, paraffin-embedded tissues. Journal of Molecular Diagnostics. 14 (1), 22-29 (2012).
- Itzkovitz, S., van Oudenaarden, A. Validating transcripts with probes and imaging technology. Nature Methods. 8 (4), S12-S19 (2011).
- Derti, A., et al. ProbeDesigner: for the design of probesets for branched DNA (bDNA) signal amplification assays. Bioinformatics. 15 (5), 348-355 (1999).
- Larson, B., Malayter, D., Shure, M. Multiplexed Detection of Cytokine Cancer Biomarkers using Fluorescence RNA In Situ Hybridization and Cellular Imaging. BioTek Application Notes. , 1-5 (2016).
- Buxbaum, A. R., Wu, B., Singer, R. H. Single β-Actin mRNA Detection in Neurons Reveals a Mechanism for Regulating Its Translatability. Science. 343 (6169), 419-422 (2014).
- Thompson, R. E., Larson, D. R., Webb, W. W. Precise nanometer localization analysis for individual fluorescent probes. Biophysical Journal. 82 (5), 2775-2783 (2002).
- Herrick, J. R., Paik, T., Strauss, K. J., Schoolcraft, W. B., Krisher, R. L. Building a better mouse embryo assay: effects of mouse strain and in vitro maturation on sensitivity to contaminants of the culture environment. Journal of Assisted Reproduction and Genetics. 33 (2), 237-245 (2016).
- Pohlmeier, W. E., Xie, F., Kurz, S. G., Lu, N., Wood, J. R. Progressive obesity alters the steroidogenic response to ovulatory stimulation and increases the abundance of mRNAs stored in the ovulated oocyte. Molecular Reproduction and Development. 81 (8), 735-747 (2014).
- Xie, F., Anderson, C. L., Timme, K. R., Kurz, S. G., Fernando, S. C., Wood, J. R. Obesity-dependent increases in oocyte mRNAs are associated with increases in proinflammatory signaling and gut microbial abundance of lachnospiraceae in female mice. Endocrinology. 157 (4), 1630-1643 (2016).
- Hirao, Y., Yanagimachi, R. Detrimental effect of visible light on meiosis of mammalian eggs in vitro. Journal of Experimental Zoology. , (1978).
- Takenaka, M., Horiuchi, T., Yanagimachi, R. Effects of light on development of mammalian zygotes. Proceedings of the National Academy of Sciences. 104 (36), 14293-14293 (2007).
- Komminoth, P., Werner, M. Target and signal amplification: Approaches to increase the sensitivity of in situ hybridization. Histochemistry and Cell Biology. 108 (4-5), 325-333 (1997).
- Hornick, J. E., Duncan, F. E., Shea, L. D., Woodruff, T. K. Multiple follicle culture supports primary follicle growth through paracrine-acting signals. Reproduction. 145 (1), 19-32 (2013).
- Vlasova-St. Louis, I., Bohjanen, P. Feedback Regulation of Kinase Signaling Pathways by AREs and GREs. Cells. 5 (1), 4 (2016).
- Gilbert, C., Svejstrup, J. Q. RNA Immunoprecipitation for Determining RNA-Protein Associations In Vivo. Current Protocols in Molecular Biology. 75 (1), 27.4.1-27.4.11 (2006).
- Kwon, S., Chin, K., Nederlof, M., Gray, J. W. Quantitative, in situ analysis of mRNAs and proteins with subcellular resolution. Scientific Reports. 7 (1), 16459 (2017).
- Voigt, F., et al. Single-Molecule Quantification of Translation-Dependent Association of mRNAs with the Endoplasmic Reticulum. Cell Reports. 21 (13), 3740-3753 (2017).
- Halstead, J. M., Wilbertz, J. H., Wippich, F., Lionnet, T., Ephrussi, A., Chao, J. A. TRICK: A Single-Molecule Method for Imaging the First Round of Translation in Living Cells and Animals. Methods in Enzymology. 572, (2016).
- Cookson, W., Liang, L., Abecasis, G., Moffatt, M., Lathrop, M. Mapping complex disease traits with global gene expression. Nature Reviews Genetics. 10 (3), 184-194 (2009).
- Houle, D., Govindaraju, D. R., Omholt, S. Phenomics: the next challenge. Nature Reviews Genetics. 11, 855 (2010).
- Freimer, N., Sabatti, C. The Human Phenome Project. Nature Genetics. 34, 15 (2003).

