DNA架橋ポリアクリルアミドハイドロゲルの調製
Summary
当研究室では、より良い細胞機能に組織の硬さを調節する効果を理解するためにDNA架橋ポリアクリルアミドハイドロゲル、動的なヒドロゲル系を開発しました。ここでは、これらのヒドロゲルを調製するための回路図、説明、およびプロトコルを提供する。
Abstract
メカノは、細胞の形態と機能を向ける内の物理的な手がかりの重要な役割に対処する新たな科学的な領域です。組織の剛性は、疾患、発達、および傷害に調節するため、例えば、細胞機能に対する組織の弾性の影響は、メカノ研究の主要な領域である。細胞がプレーティングされると剛性を変えることができない静的な組織模倣物質、または物質は、主に細胞の機能上の組織の剛性の影響を調査するために使用される。静的試験から収集した情報は貴重であるが、これらの研究は、 生体内での細胞の微小環境の動的な性質を示すものではありません。より良い細胞機能に対する動的剛性の影響に対処するために、DNA架橋ポリアクリルアミドヒドロゲルシステム(DNAゲル)を開発した。他の動的基質とは異なり、DNAゲルは、減少または刺激することなく、製造後に剛性が増加する能力を持っている。 DNAゲルは、DNAのcrosslから成りポリアクリルアミドバックボーンに重合されるインク。追加および一本鎖DNAの送達を介して架橋を除去することは、時間、空間、およびゲル弾性の可逆的制御を可能にする。私たちは、DNAゲルの弾力性の動的調節が線維芽細胞と神経細胞の挙動に影響を与えることがこれまでの報告に示されている。本報告書やビデオでは、準備のDNAゲル上でDNAゲルの架橋メカニズムと、ステップ·バイ·ステップの手順を説明する模式図を提供する。
Introduction
静的および動的な基板は、細胞機能に対する組織弾性または剛性の効果を研究するために開発された生体材料の二つのカテゴリーである。静的基板は、それらが製造された後、および/または細胞がプレーティングされれば、それらの物理的特性を変更することはできません。ポリアクリルアミド(PA)ゲルはメカノ調査5,17ために合成した第1の2次元、静的な基質であった。 PAゲルは、調製が容易で、安価で、多用途であり、弾性率の広い範囲で製造できる。これらの技術的利点は、PAが一般的に適用される基板をゲル化することが、静的な基質は、細胞外マトリックス(ECM)の動的な性質を示すものではないし、インビボで細胞環境を取り囲む。例えば、ECMは、傷害、開発、または疾患の結果としての剛性の変化を受ける。ダイナミック基板は、したがって、メカノ研究における組織模倣基質モデルとして好まれる<sup> 22,24,25。
多数の合成は、天然の、二次元、三次元の、静的および動的な生体材料は、組織1,3,6,16,23,26剛性を模倣するために開発されている。いくつかの動的な基板は、それらの機械的特性2,4,7,8,12,15,16を変更するために、熱、紫外線、電流、イオン、pH変化が必要ですが、これらの刺激は、ヒドロゲルのバイオアプリケーションを制限することができます。 DNA架橋ポリアクリルアミドヒドロゲル(DNAゲル)は、動的二次元弾性基質である。 DNAの架橋は、メディアへの一本鎖DNA(ssDNA)の添加によってDNAゲルの剛性の時間的、空間的、可逆変調のために許可または9-11,13,14,18,21バッファ 。刺激は弾力性の調節のために適用され、上記の動的なゲルとは異なり、DNAゲルは、弾力性の変化のために適用された一本鎖DNAの拡散に依存している。したがって、細胞を増殖さ上部ゲル表面は、レートoをので、変調された第1の領域であるF弾性変調はゲルの厚さに依存している。
DNAゲルは、しかしながら、ビス-アクリルアミド架橋はDNA( 図1)からなる架橋で置き換えられ、それらはポリアクリルアミド骨格を有するという点で、それらのPAゲル対応物に類似している。二つのssDNA(SA1とSA2)は、ゲルのDNA架橋を補うために、架橋剤ストランド(L2)とハイブリダイズ。 SA1とSA2は、両方のPAネットワークへの効果的な取り込みのために、5 '端にアクリダイト修正が含まれている明確な配列を有する。ゲル、SA1およびSA2の調製のために個別にPA主鎖に重合されると、その後、重合されたSA1およびSA2を一緒に混合する。 L2、架橋剤は、SA1およびSA2混合物に添加される。 L2の塩基配列は、両方SA1およびSA2配列に相補的であり、L2は、DNA架橋を形成するSA1プラスSA2とハイブリダイズする。初期、DNAゲルの弾性は、L2濃度および架橋( 表1の両方によって決定される</strong>と2)。 SA1およびSA2は、(100%ゲルと呼ぶ)L2 100質量%架橋されているため、L2、SA1およびSA2の等しい化学量論量を含むDNAゲルは、硬いゲルである。 DNA架橋の低い割合でのL2結果のより低い濃度であり、したがって、よりソフトなDNAゲル。 (50%ゲルと呼ぶ)50%架橋された程度の低いゲルは9-11構築されている。
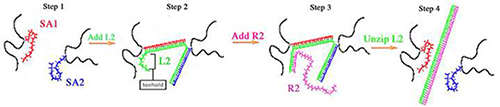
図1:DNAゲル架橋およびuncrosslinking概略図9-11,13,14,18,21手順1:SA1(赤)とSA2(青)を個別にポリアクリルアミドバックボーン(黒)に重合される。重合後、SA1およびSA2重合溶液が一緒に混合される。ステップ2:L2(緑)を添加し、ゲルの架橋を形成するSA1プラスSA2とハイブリダイズされる。ステップ3:R2がtとハイブリダイズ彼は、L2の足掛かり。ステップ4:R2の足掛かりハイブリダイゼーションは、SA1とSA2からL2の解凍を推進。
PAゲルとは異なり、DNAゲルは、合成後に硬くかつ柔らかくすることができます。そのため、DNAのゲル上で増殖した細胞は、動剛性の変化に供することができる。細胞接着性ゲルを補強するために、L2は、架橋の割合を増加させるために低いパーセンテージのゲルの培養培地に添加することができる。細胞接着性ゲルを柔らかくするために、L2は、架橋10,13,21の割合を減少させるために除去することができる。 L2は、L2は、SA1およびSA2( 表1)からuncrosslinkできるように、3 '端に付加的な足掛かり配列を有する。 L2の除去は、R2と呼ばれる反転鎖のハイブリダイゼーションによって達成される。 R2はL2の全長に相補的であり、L2の足掛かりを最初にハイブリダイズする。足掛かりハイブリダイゼーションは架橋を排除し、ゲル剛性を減少させSA1とSA2からL2の解凍を推進する。
本報告ではとビデオは、段階的な手順は、DNAゲルを補強し、軟化させるの調製のために設けられている。 100%および80%ゲル製剤が記載されているが、このプロトコルは、他の初期および最終の架橋割合のDNAゲルを作成するために調整することができる。一般に、100%および80%ゲルを用意し、ガラスカバースリップ上に固定化、官能化、および細胞を播種。 L2は、80%ゲルの培地に添加され、R2は、100%のゲル、メッキの48時間後の培地に添加する。メディアへのR2の添加が80%架橋、100%ゲルを柔らかくし、一方メディアにL2の添加は、架橋された100%、80%ゲルを硬くする。剛化ゲルを80→100%ゲル軟化ゲルとして指定されているテキストで100→80%のゲルとして指定されている。制御または静的ゲル、ssDNAのためにTsとから成るかのように、100%および80%ゲルの別のセットに配信される。弾性変調次の二日間の最小限の後、細胞を処理し、分析することができる。
<table border="0" cellpadding="0" cellspacing="0" fo:keep-together.within-ページ= "常に">セルラーと機械の研究をd、いくつか利用している。のssDNA 9-11,13,14,18,21表1に塩基配列ifferent架橋設計は、静的および動的機械的特性の範囲を有するDNAゲルを生成する。架橋設計において変調パラメータは、塩基配列と、配列の長さまたは架橋の長さである。太字やイタリック体のフォントは、SA1とL2との間にそれぞれSA2とL2の間の塩基対形成を示している。
| デザイン | ||||||||
| 1 | 2 | 3 | ||||||
| アクリルアミド濃度(%) | 10 | 10 | 10 | 4 | ||||
| SA1プラスL2にハイブリダイズSA2(%架橋) | 50 | 80 | 100 | 50 | 80 | 100 | 100 | 100 |
| <強い>弾力性(キロパスカル、平均±SEM) | 6.6±0.6 | 17.1±0.8 | 29.8±2.5 | 5.85±0.62 | 12.67±1.33 | 22.88±2.77 | 25.2±0.5 | 10.4±0.6 |
DNAゲルの表2ヤング率(E)9-11,13,14,18,21。アクリルアミド濃度、架橋の割合、および架橋の長さはDNAゲルに変調することができる。設計1,2、及び3は、それぞれ、20,28、および40 bpの架橋長さを有する。すべてのデザインのための100%のゲルは、ゲル弾性に影響を与えない架橋長さを示す類似の弾性率を持っている。しかし、アクリルアミド濃度のばらつきはDNAゲルの弾性を変化させる。
Protocol
Representative Results
Discussion
細胞接着は、それらの細胞機能に対する動的な組織の剛性の役割を研究するための理想的なモデルとなる前と後の軟化または硬くするDNAゲルの能力。すべての3つの設計では、機械的および生物学的研究に使用されている。しかし、すべての3つのデザインは、架橋の長さはDNAゲル弾性( 表2)影響を与えないことを示す、さまざまな架橋の割合で同様弾力性を持っている。これと?…
Divulgations
The authors have nothing to disclose.
Acknowledgements
作者は感謝したいと思います:博士フランク·江、デビッド·リン博士バーナードYurke博士ウダイChippadaをDNAゲル技術の開発に貢献するために、博士ノレルHadzimichalis、スミット·シャー、キンバリーピーターマン、ロバートArterこの原稿の彼らのコメントや編集をするため;脊髄研究に関するニュージャージー委員会(助成#07A-019-SCR1、NAL)とニュージャージー神経科学研究所(MLP)を含む資金調達源; 図3を転載する許可を図2と図4およびバイオマテリアルを転載する許可のための組織工学のパブリッシャー、パートA。
Materials
| ssDNA | Integrated DNA Technologies (Coralville, Iowa) idtdna.com |
Do not vortex ssDNA. Gentle invert the vial and/or pipette solution to mix. | |
| PBS with calcium and magnesium | Any brand. | ||
| 100X Tris-EDTA buffer (TE buffer) | Sigma-Aldrich (St. Loius, MO) sigmaldrich.com |
T9285 | |
| 10X Tris-Borate-EDTA buffer (TBE buffer) | Sigma-Aldrich (St. Loius, MO) | 93290 | TBE is a reproductive toxin. |
| 40% Acrylamide solution | Fisher Scientific (Pittsburg, PA) | BP14021 | Acrylamide is a toxin. |
| Ammonium persulfate (APS) | Sigma-Aldrich (St. Loius, MO) | A3678 | Prepare a 2% solution in TE buffer. APS is a toxin and irratant. |
| Tetramethylethylenediamine (TEMED) | Sigma-Aldrich (St. Loius, MO) | T9281 | Prepare a 20% solution in TE buffer. TEMED is flammable, a corrosive, and a toxin. |
| 12-mm diameter round coverglass | Fisher Scientific (Pittsburg, PA) fishersci.com |
12-545-82 | |
| Norland optical adhesive 72 | Norland Products (Cranbury, NJ) norlandprod.com |
NOA72 | |
| 24-well tissue culture plate | Any brand. | ||
| Microcentrifuge tubes | Any brand. | ||
| Sulfo-SANPAH | ProteoChem or Thermo Fisher, (Rockland, IL) proteochem.com or thermofisher.com |
C111 or 22589 | Prepare a 0.315 mg/ml solution in water immediately before use. Dissolve at 37°C and filter sterilze. It is normal to observe undisolved sulfo-SANPAH in the filter. Sulfo-SANPAH is light sensitive and, therefore, the solution should be protect from light until UV exposure. |
| Poly-D-Lysine (PDL) | Sigma-Aldrich (St. Loius, MO) | P6407 | Prepare a 0.2 mg/ml solution in water and filter sterilize. |
| Collagen Type I | Affymetrix (Santa Clara, CA) affymetrix.com |
13813 | Prepare a 0.2 mg/ml solution in 0.2 N acetic acid. Solution needs to remain cold at all times to avoid polymerization. Acetic acid is a flammable, toxic, and corrosive. |
| 22 X 60 cover glass | Fisher Scientific (Pittsburg, PA) | 12-544-G | |
| Positive-displacement pipette | Gilson, Inc (Middletown, WI) gilson.com |
F148504 | |
| Heat block | Fisher Scientific (Pittsburg, PA) | 11-718 | |
| UV light source | Place gels as close as possible to the UV light. UV light can cause skin or eye injury. | ||
| Thermometer | Any brand. | ||
| Nitrogen gas | GTS-Welco (Flemington, NJ) www.praxairmidatlantic.com/ |
NI 5.0UH-R |
References
- Balaban, N. Q., et al. Force and focal adhesion assembly A close relationship studied using elastic micropatterned substrates. Nat Cell Biol. 3 (5), 466-472 (2001).
- Peppas Brannon-Peppas, L., Peppas, N. A. Dynamic and equilibrium swelling behaviour of ph-sensitive hydrogels containing 2-hydroxyethyl methacrylate. Biomaterials. 11 (9), 635-644 (1990).
- Charati, M. B., Ifkovits, J. L., Burdick, J. A., Linhardt, J. G., Kiick, K. L. Hydrophilic elastomeric biomaterials based on resilin-like polypeptides. Soft Matter. 5 (18), 3412-3416 (2009).
- Davis, K. A., Burke, K. A., Mather, P. T., Henderson, J. H. Dynamic cell behavior on shape memory polymer substrates. Biomaterials. 32 (9), 2285-2293 (2011).
- Dembo, M., Wang, Y. L. Stresses at the cell-to-substrate interface during locomotion of fibroblasts. Biophys J. 76 (4), 2307-2316 (1999).
- Gray, D. S., Tien, J., Chen, C. S. Repositioning of cells by mechanotaxis on surfaces with micropatterned youngs modulus. J Biomed Mater Res A. 66 (3), 605-614 (2003).
- Homma, M., Seida, Y., Nakano, Y. Effect of ions on the dynamic behavior of an electrodriven ionic polymer hydrogel membrane. Journal of applied Polymer Science. 82 (1), 76-80 (2001).
- Horkay, F., Tasaki, I., Basser, P. J. Osmotic swelling of polyacrylate hydrogels in physiological salt solutions. Biomacromolecules. 1 (1), 84-90 (2000).
- Jiang, F. X., Yurke, B., Firestein, B. L., Langrana, N. A. Neurite outgrowth on a DNA crosslinked hydrogel with tunable stiffnesses. Ann Biomed Eng. 36 (9), 1565-1579 (2008).
- Jiang, F. X., Yurke, B., Schloss, R. S., Firestein, B. L., Langrana, N. A. Effect of dynamic stiffness of the substrates on neurite outgrowth by using a DNA-crosslinked hydrogel. Tissue Engineering Part A. 16 (6), 1873-1889 (2010).
- Jiang, F. X., Yurke, B., Schloss, R. S., Firestein, B. L., Langrana, N. A. The relationship between fibroblast growth and the dynamic stiffnesses of a DNA crosslinked hydrogel. Biomaterials. 31 (6), 1199-1212 (2010).
- Kloxin, A. M., Tibbitt, M. W., Anseth, K. S. Synthesis of photodegradable hydrogels as dynamically tunable cell culture platforms. Nat Protoc. 5 (12), 1867-1887 (2010).
- Lin, D. C., Yurke, B., Langrana, N. A. Mechanical properties of a reversible, DNA-crosslinked polyacrylamide hydrogel. J Biomech Eng. 126 (1), 104-110 (2004).
- Lin, D. C., Yurke, B., Langrana, N. A. Use of rigid spherical inclusions in young’s moduli determination: Application to DNA-crosslinked gels. J Biomech Eng. 127 (4), 571-579 (2005).
- Luo, Y., Shoichet, M. S. Light-activated immobilization of biomolecules to agarose hydrogels for controlled cellular response. Biomacromolecules. 5 (6), 2315-2323 (2004).
- Marklein, R. A., Burdick, J. A. Spatially controlled hydrogel mechanics to modulate stem cell interactions. Soft Matter. 6 (1), 136-143 (2010).
- Pelham Jr, R. J., Wang, Y. Cell locomotion and focal adhesions are regulated by substrate flexibility. Proc Natl Acad Sci U S A. 94 (25), 13661-13665 (1997).
- Previtera, M. L., Chippada, U., Schloss, R. S., Yurke, B., Langrana, N. A. Mechanical properties of DNA-crosslinked polyacrylamide hydrogels with increasing crosslinker density. BioResearch Open Access. 1 (5), 256-259 (2012).
- Previtera, M. L., Langhammer, C. G., Firestein, B. L. Effects of substrate stiffness and cell density on primary hippocampal cultures. J Biosci Bioeng. 110 (4), 459-470 (2010).
- Previtera, M. L., Langhammer, C. G., Langrana, N. A., Firestein, B. L. Regulation of dendrite arborization by substrate stiffness is mediated by glutamate receptors. Ann Biomed Eng. 38 (12), 3733-3743 (2010).
- Previtera, M. L., Trout, K. L., Verma, D., Chippada, U., Schloss, R. S., Langrana, N. A. Fibroblast morphology on dynamic softening of hydrogels. Ann Biomed Eng. 40 (5), 1061-1072 (2012).
- Saxena, T., Gilbert, J., Stelzner, D., Hasenwinkel, J. Mechanical characterization of the injured spinal cord after lateral spinal hemisection injury in the rat. J Neurotrauma. 29 (9), 1747-1757 (2012).
- Sundararaghavan, H. G., Monteiro, G. A., Firestein, B. L., Shreiber, D. I. Neurite growth in 3d collagen gels with gradients of mechanical properties. Biotechnol Bioeng. 102 (2), 632-643 (2009).
- Wozniak, M. A., Chen, C. S. Mechanotransduction in development A growing role for contractility. Nat Rev Mol Cell Biol. 10 (1), 34-43 (2009).
- Wuerfel, J., et al. Mr-elastography reveals degradation of tissue integrity in multiple sclerosis. Neuroimage. 49 (3), 2520-2525 (2012).
- Zaari, N., Rajagopalan, P., Kim, S. K., Engler, A. J., Wong, J. Y. Photopolymerization in microfluidic gradient generators Microscale control of substrate compliance to manipulate cell response. Adv Mater. 16 (23-24), 2133-2137 (2004).

