Подготовка ДНК-сшитый полиакриламидных гидрогелей
Summary
Наша лаборатория разработала ДНК-сшитый полиакриламид гидрогели, динамическую систему гидрогеля, чтобы лучше понять эффекты модуляции ткани жесткость на функции клеток. Здесь мы предоставляем схемы, описания и протоколы по подготовке этих гидрогели.
Abstract
Mechanobiology является новым научно область, которая рассматривается принципиально важная роль физических сигналов в направляя морфологию и функции клеток. Например, эффект эластичности тканей на функции клеток является одной из основных областей mechanobiology исследований, потому что ткани жесткость модулирует с болезнями, развития и травмы. Статические ткани имитирующие материалы или материалы, которые не могут изменить жесткость раз клетки высевают, которые преимущественно используются для изучения влияния ткани жесткости на клеточных функций. В то время как информация, собранная из статических исследований ценно, эти исследования не свидетельствуют о динамической природе сотовой микросреды в естественных условиях. Для более эффективного решения эффекты динамической жесткости на функции клеток, мы разработали ДНК-сшитый систему полиакриламидного гидрогеля (гели ДНК). В отличие от других динамических подложках, гели ДНК обладают способностью уменьшать или увеличивать в жесткости после изготовления без стимулов. Гели ДНК состоят из crossl ДНКчернила, которые полимеризуются в полиакриламидном позвоночника. Добавление и удаление сшивки через доставку одноцепочечной ДНК позволяет временные, пространственные и обратимым контроль эластичности геля. Мы показали в предыдущих докладах, что динамическая модуляция упругости геля ДНК влияет фибробластов и нейронов поведение. В этом докладе и видео, мы предоставляем схему, которая описывает гель ДНК механизмы сшивания и шаг за шагом инструкции по гелей подготовка ДНК.
Introduction
Статические и динамические субстраты две категории биоматериалов, которые были разработаны, чтобы изучить эффекты ткани эластичности или жесткости на функции клеток. Статические субстраты не в состоянии изменить свои физические свойства после того как они изготавливаются и / или раз клетки высевают. Полиакриламидные (PA) гели были первые двумерные статические субстраты, которые были синтезированы для mechanobiology исследований 5,17. PA гели легко приготовить, недорогой, универсальный, и может быть изготовлен с широким диапазоном модулей упругости. Хотя эти технические преимущества делают PA гели с широко применяется субстрат, статические субстраты не свидетельствует о динамической природе внеклеточного матрикса (ECM) и окружающей клеточной среде в естественных условиях. Например, ECM подвергается жесткости изменения в результате травмы, развития или заболевания. Динамические субстраты поэтому выступает как ткани имитирующие моделей подложки в mechanobiology исследований <sup> 22,24,25.
Многочисленные синтетические, натуральные, двумерные, трехмерные, статические и динамические биоматериалы были разработаны, чтобы имитировать ткани жесткость 1,3,6,16,23,26. Некоторые динамические субстраты требуют тепла, УФ, электрический ток, ионы, и изменения рН изменить свои механические свойства 2,4,7,8,12,15,16, но эти стимулы могут ограничить био-приложение гидрогеля в. ДНК-сшитый полиакриламид гидрогели (гели ДНК) являются динамичный двухмерный упругие субстраты. Сшивки ДНК позволяют временной, пространственной, и обратимой модуляцией гель ДНК жесткости добавлением одноцепочечной ДНК (оцДНК) к средствам массовой информации или буфер 9-11,13,14,18,21. В отличие от указанных выше динамических гелей, где раздражители применяются для модуляции упругости, гели ДНК основаны на диффузии прикладной оцДНК для изменения упругости. Таким образом, верхняя поверхность геля, где выращивают клетки, является первой областью модулированный так как скорость выводаF упругости модуляции зависит от толщины геля.
Гели ДНК схожи с их аналогами гель ПА в том, что они имеют полиакриламидном основу, однако бис-акриламида сшивки заменены, составленных из сшивок ДНК (рисунок 1). Два ssDNAs (SA1 и SA2) гибридизации с сшивателя нити (L2), чтобы составить сшивки ДНК в геле. SA1 и SA2 имеют различные последовательности, что и содержащие модификацию Acrydite в конце 5'для эффективного включения в сети ООПТ. Для подготовки гели, SA1 и SA2 индивидуально полимеризуется в позвоночнике Звуковая и, впоследствии, полимеризованный SA1 и SA2 смешиваются. L2, сшивающий агент, добавляют к SA1 и SA2 смеси. Последовательность оснований L2 является дополнением к обоим SA1 и SA2 последовательностей и L2 гибридизуется с SA1 SA2 плюс для формирования сшивок ДНК. Начальное, упругость гель ДНК определяется как концентрации L2 и сшивания (таблицы 1 </сильный> и 2). Гели ДНК, содержащие равные стехиометрических количеств L2, SA1, SA2 и являются армированных гели потому SA1 и SA2 100% сшитый L2 (обозначенного как 100% гелей). Более низкие концентрации L2 результате в более низкий процент сшивки ДНК и, следовательно, более мягкие гели ДНК. Гели, как низкие, как 50% сшитого (обозначены как 50% гели) были построены 9-11.
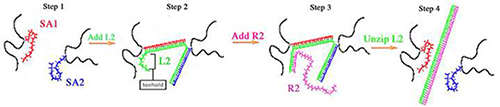
Рис.1 гель ДНК сшивания и uncrosslinking принципиальная 9-11,13,14,18,21 Шаг 1:. SA1 (красный) и SA2 (синий) индивидуально полимеризуется в полиакриламидном позвоночника (черный). После полимеризации SA1 и SA2 Полимеризованные растворы смешивают вместе. Шаг 2: L2 (зеленый) добавляется и гибридизуется с SA1 SA2 плюс для формирования сшивки геля. Шаг 3: R2 гибридизуется с тон опоры из L2. Шаг 4: опоры гибридизация R2 продвигает распаковки из L2 от SA1 и SA2.
В отличие от ПА гелей, гелей ДНК могут ужесточить и смягчить после синтеза. По этой причине, клетки, выращенные на гелей ДНК могут быть подвергнуты динамических изменений жесткости. Для придания жесткости гели клеток прилипания, L2, могут быть добавлены в культуральную среду низких процентных гелей, чтобы увеличить процент сшивок. Чтобы смягчить гели клеток-единомышленником, L2 могут быть удалены, чтобы уменьшить процент сшивки 10,13,21. L2 имеет дополнительное последовательность опоры в конце 3', чтобы позволить L2, чтобы uncrosslink от SA1 и SA2 (Таблица 1). Удаление L2 осуществляется путем гибридизации разворота нити под названием R2. R 2 является дополнением к полной длины L2 и гибридизуется с первым плацдарм L2. Опоры гибридизации продвигает распаковки из L2 от SA1 и SA2, что исключает поперечных связей и снижает жесткость геля.
В этом докладе, ивидео, шаг за шагом инструкции предназначены для подготовки жесткости и смягчения гели ДНК. В то время как 100% и 80% гель препараты описаны, этот протокол может быть адаптирована для создания гели ДНК других начальных и конечных сшитых процентах. В общем, 100% и 80% гели получают, иммобилизуют на стекло покровные стекла, функционализированные и засевали клетками. L2, добавляется в средствах массовой информации 80% гели и R2 добавляется в средствах массовой информации о 100% гелей, 48 ч после посева. Добавление L2 на носитель застывает 80% гели в 100% сшитый, в то время как добавление R2 на носитель смягчает 100% гели с 80% сшитого. Окоченевшего гели обозначены как 80 → 100% гелей и смягченные гели обозначаются как 100 → 80% гели в тексте. Для контроля или статических гелей, одноцепочечной ДНК, состоящая из Ц. или Как доставляется к другому набору 100% и 80% гелей. После не менее двух дней, следующих упругости модуляции, клетки могут быть обработаны и проанализированы.
<table border="0" cellpadding="0" cellspacing="0" fo:kЕЭП-together.within-страница = "всегда">Таблица 1 Базовые последовательности для одноцепочечной ДНК 9-11,13,14,18,21. Сотовый и механические исследования использованы несколько дifferent поперечные конструкции для создания гелей ДНК с рядом статических и динамических механических свойств. Параметры модулированные в дизайне сшивки являются последовательность оснований и длина последовательности или длина сшивки. Смелые и курсивом шрифты иллюстрируют спаривание оснований между SA1 и L2, а также между SA2 и L2 соответственно.
| Дизайн | ||||||||
| 1 | 2 | 3 | ||||||
| Акриламид Концентрация (%) | 10 | 10 | 10 | 4 | ||||
| SA1 плюс SA2 гибридизации с L2 (% сшитого) | 50 | 80 | 100 | 50 | 80 | 100 | 100 | 100 |
| <сильный> Эластичность (кПа, среднее ± SEM) | 6.6 ± 0.6 | 17,1 ± 0,8 | 29,8 ± 2,5 | 5.85 ± 0.62 | 12.67 ± 1.33 | 22.88 ± 2.77 | 25,2 ± 0,5 | 10.4 ± 0.6 |
Таблица 2 модуль Юнга (Е) гелей ДНК 9-11,13,14,18,21. Концентрации акриламида, сшивки и процент длины сшивки можно модулировать в геле ДНК. Конструкции 1, 2, и 3 имеют 20, 28, и 40 п.о. поперечных длин, соответственно. 100% гели для всех конструкций имеют аналогичные модули, указывающий сшивания длину не влияет эластичность геля. Тем не менее, вариации в концентрации акриламида изменить эластичность ДНК из геля.
Protocol
Representative Results
Discussion
Способность гелей ДНК, чтобы смягчить или ужесточить до и после клеточной адгезии делает их идеальным модель для изучения роли динамической жесткости ткани на функции клеток. Все три конструкции были использованы в механических и биологических исследований. Тем не менее, все три имею?…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Авторы хотели бы поблагодарить: д-р Франк Цзян, доктор Дэвид Лин, доктор Бернард Yurke и доктора Uday Chippada за их вклад по разработке технологии геля ДНК; Доктор Норелл Hadzimichalis, Смит Шах, Кимберли Peterman, Роберт Arter за их комментарии и правок этой рукописи; источники финансирования, включая Нью-Джерси комиссии по спинного мозга исследований (грант # 07A-019-SCR1, NAL) и Нью-Джерси Neuroscience Institute (MLP); и издатели тканевой инженерии, часть за разрешение перепечатать рисунки 2 и 4 и биоматериалов для получения разрешения на перепечатку Рисунок 3.
Materials
| ssDNA | Integrated DNA Technologies (Coralville, Iowa) idtdna.com |
Do not vortex ssDNA. Gentle invert the vial and/or pipette solution to mix. | |
| PBS with calcium and magnesium | Any brand. | ||
| 100X Tris-EDTA buffer (TE buffer) | Sigma-Aldrich (St. Loius, MO) sigmaldrich.com |
T9285 | |
| 10X Tris-Borate-EDTA buffer (TBE buffer) | Sigma-Aldrich (St. Loius, MO) | 93290 | TBE is a reproductive toxin. |
| 40% Acrylamide solution | Fisher Scientific (Pittsburg, PA) | BP14021 | Acrylamide is a toxin. |
| Ammonium persulfate (APS) | Sigma-Aldrich (St. Loius, MO) | A3678 | Prepare a 2% solution in TE buffer. APS is a toxin and irratant. |
| Tetramethylethylenediamine (TEMED) | Sigma-Aldrich (St. Loius, MO) | T9281 | Prepare a 20% solution in TE buffer. TEMED is flammable, a corrosive, and a toxin. |
| 12-mm diameter round coverglass | Fisher Scientific (Pittsburg, PA) fishersci.com |
12-545-82 | |
| Norland optical adhesive 72 | Norland Products (Cranbury, NJ) norlandprod.com |
NOA72 | |
| 24-well tissue culture plate | Any brand. | ||
| Microcentrifuge tubes | Any brand. | ||
| Sulfo-SANPAH | ProteoChem or Thermo Fisher, (Rockland, IL) proteochem.com or thermofisher.com |
C111 or 22589 | Prepare a 0.315 mg/ml solution in water immediately before use. Dissolve at 37°C and filter sterilze. It is normal to observe undisolved sulfo-SANPAH in the filter. Sulfo-SANPAH is light sensitive and, therefore, the solution should be protect from light until UV exposure. |
| Poly-D-Lysine (PDL) | Sigma-Aldrich (St. Loius, MO) | P6407 | Prepare a 0.2 mg/ml solution in water and filter sterilize. |
| Collagen Type I | Affymetrix (Santa Clara, CA) affymetrix.com |
13813 | Prepare a 0.2 mg/ml solution in 0.2 N acetic acid. Solution needs to remain cold at all times to avoid polymerization. Acetic acid is a flammable, toxic, and corrosive. |
| 22 X 60 cover glass | Fisher Scientific (Pittsburg, PA) | 12-544-G | |
| Positive-displacement pipette | Gilson, Inc (Middletown, WI) gilson.com |
F148504 | |
| Heat block | Fisher Scientific (Pittsburg, PA) | 11-718 | |
| UV light source | Place gels as close as possible to the UV light. UV light can cause skin or eye injury. | ||
| Thermometer | Any brand. | ||
| Nitrogen gas | GTS-Welco (Flemington, NJ) www.praxairmidatlantic.com/ |
NI 5.0UH-R |
References
- Balaban, N. Q., et al. Force and focal adhesion assembly A close relationship studied using elastic micropatterned substrates. Nat Cell Biol. 3 (5), 466-472 (2001).
- Peppas Brannon-Peppas, L., Peppas, N. A. Dynamic and equilibrium swelling behaviour of ph-sensitive hydrogels containing 2-hydroxyethyl methacrylate. Biomaterials. 11 (9), 635-644 (1990).
- Charati, M. B., Ifkovits, J. L., Burdick, J. A., Linhardt, J. G., Kiick, K. L. Hydrophilic elastomeric biomaterials based on resilin-like polypeptides. Soft Matter. 5 (18), 3412-3416 (2009).
- Davis, K. A., Burke, K. A., Mather, P. T., Henderson, J. H. Dynamic cell behavior on shape memory polymer substrates. Biomaterials. 32 (9), 2285-2293 (2011).
- Dembo, M., Wang, Y. L. Stresses at the cell-to-substrate interface during locomotion of fibroblasts. Biophys J. 76 (4), 2307-2316 (1999).
- Gray, D. S., Tien, J., Chen, C. S. Repositioning of cells by mechanotaxis on surfaces with micropatterned youngs modulus. J Biomed Mater Res A. 66 (3), 605-614 (2003).
- Homma, M., Seida, Y., Nakano, Y. Effect of ions on the dynamic behavior of an electrodriven ionic polymer hydrogel membrane. Journal of applied Polymer Science. 82 (1), 76-80 (2001).
- Horkay, F., Tasaki, I., Basser, P. J. Osmotic swelling of polyacrylate hydrogels in physiological salt solutions. Biomacromolecules. 1 (1), 84-90 (2000).
- Jiang, F. X., Yurke, B., Firestein, B. L., Langrana, N. A. Neurite outgrowth on a DNA crosslinked hydrogel with tunable stiffnesses. Ann Biomed Eng. 36 (9), 1565-1579 (2008).
- Jiang, F. X., Yurke, B., Schloss, R. S., Firestein, B. L., Langrana, N. A. Effect of dynamic stiffness of the substrates on neurite outgrowth by using a DNA-crosslinked hydrogel. Tissue Engineering Part A. 16 (6), 1873-1889 (2010).
- Jiang, F. X., Yurke, B., Schloss, R. S., Firestein, B. L., Langrana, N. A. The relationship between fibroblast growth and the dynamic stiffnesses of a DNA crosslinked hydrogel. Biomaterials. 31 (6), 1199-1212 (2010).
- Kloxin, A. M., Tibbitt, M. W., Anseth, K. S. Synthesis of photodegradable hydrogels as dynamically tunable cell culture platforms. Nat Protoc. 5 (12), 1867-1887 (2010).
- Lin, D. C., Yurke, B., Langrana, N. A. Mechanical properties of a reversible, DNA-crosslinked polyacrylamide hydrogel. J Biomech Eng. 126 (1), 104-110 (2004).
- Lin, D. C., Yurke, B., Langrana, N. A. Use of rigid spherical inclusions in young’s moduli determination: Application to DNA-crosslinked gels. J Biomech Eng. 127 (4), 571-579 (2005).
- Luo, Y., Shoichet, M. S. Light-activated immobilization of biomolecules to agarose hydrogels for controlled cellular response. Biomacromolecules. 5 (6), 2315-2323 (2004).
- Marklein, R. A., Burdick, J. A. Spatially controlled hydrogel mechanics to modulate stem cell interactions. Soft Matter. 6 (1), 136-143 (2010).
- Pelham Jr, R. J., Wang, Y. Cell locomotion and focal adhesions are regulated by substrate flexibility. Proc Natl Acad Sci U S A. 94 (25), 13661-13665 (1997).
- Previtera, M. L., Chippada, U., Schloss, R. S., Yurke, B., Langrana, N. A. Mechanical properties of DNA-crosslinked polyacrylamide hydrogels with increasing crosslinker density. BioResearch Open Access. 1 (5), 256-259 (2012).
- Previtera, M. L., Langhammer, C. G., Firestein, B. L. Effects of substrate stiffness and cell density on primary hippocampal cultures. J Biosci Bioeng. 110 (4), 459-470 (2010).
- Previtera, M. L., Langhammer, C. G., Langrana, N. A., Firestein, B. L. Regulation of dendrite arborization by substrate stiffness is mediated by glutamate receptors. Ann Biomed Eng. 38 (12), 3733-3743 (2010).
- Previtera, M. L., Trout, K. L., Verma, D., Chippada, U., Schloss, R. S., Langrana, N. A. Fibroblast morphology on dynamic softening of hydrogels. Ann Biomed Eng. 40 (5), 1061-1072 (2012).
- Saxena, T., Gilbert, J., Stelzner, D., Hasenwinkel, J. Mechanical characterization of the injured spinal cord after lateral spinal hemisection injury in the rat. J Neurotrauma. 29 (9), 1747-1757 (2012).
- Sundararaghavan, H. G., Monteiro, G. A., Firestein, B. L., Shreiber, D. I. Neurite growth in 3d collagen gels with gradients of mechanical properties. Biotechnol Bioeng. 102 (2), 632-643 (2009).
- Wozniak, M. A., Chen, C. S. Mechanotransduction in development A growing role for contractility. Nat Rev Mol Cell Biol. 10 (1), 34-43 (2009).
- Wuerfel, J., et al. Mr-elastography reveals degradation of tissue integrity in multiple sclerosis. Neuroimage. 49 (3), 2520-2525 (2012).
- Zaari, N., Rajagopalan, P., Kim, S. K., Engler, A. J., Wong, J. Y. Photopolymerization in microfluidic gradient generators Microscale control of substrate compliance to manipulate cell response. Adv Mater. 16 (23-24), 2133-2137 (2004).

