Preparación de ADN-poliacrilamida reticulada hidrogeles
Summary
Nuestro laboratorio ha desarrollado hidrogeles de poliacrilamida de ADN-reticulada, un sistema dinámico de hidrogel, para entender mejor los efectos de la modulación de la rigidez del tejido en función de la célula. Aquí, ofrecemos esquemas, descripciones y protocolos para preparar estos hidrogeles.
Abstract
Mecanobiología es un área científica emergente que aborda el papel fundamental de las señales físicas en la dirección de la morfología y la función celular. Por ejemplo, el efecto de la elasticidad de los tejidos en función de la célula es un área importante de la investigación mecanobiología porque la rigidez del tejido modula con la enfermedad, el desarrollo, y las lesiones. Materiales estáticos que imitan tejidos o materiales que no pueden alterar la rigidez una vez que se siembran las células, se utilizan principalmente para investigar los efectos de la rigidez del tejido en las funciones celulares. Si bien la información obtenida de los estudios estáticos es valiosa, estos estudios no son indicativos de la naturaleza dinámica del microambiente celular in vivo. Para abordar mejor los efectos de la rigidez dinámica en función de la célula, se desarrolló un sistema de hidrogel de poliacrilamida ADN reticulado (geles de ADN). A diferencia de otros sustratos dinámicos, geles de ADN tienen la capacidad de aumentar o disminuir la rigidez después de la fabricación y sin estímulos. Geles de ADN consisten en ADN crossltintas que se polimerizan en un esqueleto de poliacrilamida. Adición y eliminación de enlaces cruzados a través de la entrega de ADN de cadena sencilla permite temporal, espacial y de control reversible de la elasticidad del gel. Hemos demostrado en los informes anteriores que la modulación dinámica de la elasticidad del gel del ADN influye en el comportamiento de fibroblastos y la neurona. En el presente informe y el vídeo, ofrecemos un esquema que describe los mecanismos de reticulación de gel de ADN y las instrucciones paso a paso sobre los geles de ADN preparación.
Introduction
Sustratos estáticos y dinámicos son dos categorías de biomateriales que se desarrollaron para estudiar los efectos de la elasticidad de los tejidos o rigidez en la función celular. Sustratos estáticas son incapaces de cambiar sus propiedades físicas después de que se fabrican y / o una vez se siembran las células. Poliacrilamida (PA) geles fueron los primeros sustratos bidimensionales estáticas, que se sintetizaron las investigaciones mecanobiología 5,17. Geles de PA son fáciles de preparar, de bajo costo, versátil, y puede ser fabricado con una amplia gama de módulos elásticos. Aunque estas ventajas técnicas hacen PA geles un sustrato general aplicada, sustratos estáticas no son indicativos de la naturaleza dinámica de la matriz extracelular (MEC) y que rodea entorno celular in vivo. Por ejemplo, el ECM sufre alteraciones de rigidez como resultado de una lesión, el desarrollo, o la enfermedad. Por lo tanto sustratos dinámicos son favorecidos como los modelos de sustrato que imitan los tejidos en los estudios mecanobiología <sup> 22,24,25.
Numerosos sintética, bidimensional biomateriales, tridimensionales, estáticas y dinámicas naturales se han desarrollado para imitar la rigidez del tejido 1,3,6,16,23,26. Algunos sustratos dinámicos requieren calor, UV, la corriente eléctrica, los iones, y los cambios de pH para alterar sus propiedades mecánicas 2,4,7,8,12,15,16, pero estos estímulos pueden restringir bio-aplicación del hidrogel. Hidrogeles de poliacrilamida reticulada de ADN-ADN (geles) son sustratos elásticos bidimensionales dinámicos. Entrecruzamientos de ADN permiten la modulación temporal, espacial, y reversible de la rigidez en gel de ADN mediante la adición de ADN de cadena sencilla (ssDNA) a los medios o tampón 9-11,13,14,18,21. A diferencia de los geles dinámicas mencionadas anteriormente donde se aplican los estímulos para la modulación de elasticidad, los geles de ADN se basan en la difusión de ssDNA aplicada para la alteración de la elasticidad. Por lo tanto, la superficie del gel superior, donde se cultivan las células, es la primera área modulada porque el o tasamodulación f elasticidad es dependiente del espesor de gel.
Geles de ADN son similares a sus homólogos de gel de PA en que tienen un esqueleto de poliacrilamida, sin embargo, las reticulaciones-bis acrilamida se reemplazan con reticulaciones compuestas de ADN (Figura 1). Dos ssDNAs (SA1 y SA2) se hibridan con una cadena reticulante (L2) para compensar los entrecruzamientos de ADN del gel. SA1 y SA2 tienen secuencias distintas que ambos contienen una modificación Acrydite en el extremo 5 'para su incorporación efectiva a la red PA. Para la preparación de los geles, SA1 y SA2 se polimerizan individualmente en una cadena principal de PA y, posteriormente, el SA1 SA2 polimerizado y se mezclan juntos. L2, el agente de reticulación, se añade a la SA1 y SA2 mezcla. La secuencia de bases es complementaria a L2 ambas secuencias SA1 y SA2 y L2 se hibrida con SA1 SA2 más para formar los entrecruzamientos de ADN. , Elasticidad del gel de ADN inicial es determinado por ambas concentraciones L2 y reticulación (Tablas 1 </strong> y 2). Geles de ADN que contienen cantidades estequiométricas iguales de L2, SA1, SA2 y son los geles más rígidas porque SA1 y SA2 son 100% reticulado por L2 (designado como 100% geles). Concentraciones más bajas de L2 resultado en un menor porcentaje de reticulación del ADN y, por tanto, geles más blandos de ADN. Geles tan bajas como 50% reticulado (designado como 50% en geles) se han construido 9-11.
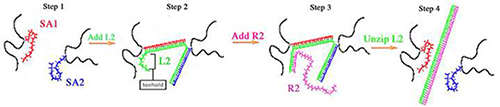
Figura 1. reticulación de gel de ADN y uncrosslinking esquemática 9-11,13,14,18,21 Paso 1:. SA1 (rojo) y SA2 (azul) se polimerizan de forma individual en una columna vertebral de poliacrilamida (negro). Después de la polimerización, soluciones polimerizadas SA1 y SA2 se mezclan juntos. Paso 2: L2 (verde) se añade y se hibrida con SA1 SA2 más para formar los entrecruzamientos del gel. Paso 3: R2 hibrida con tél punto de apoyo de la L2. Paso 4: hibridación de punto de apoyo de R2 impulsa la descompresión de la L2 de SA1 y SA2.
A diferencia de los geles de PA, geles de ADN pueden endurecerse y suavizar después de la síntesis. Por esa razón, las células cultivadas en geles de ADN pueden ser sometidos a alteraciones de rigidez dinámica. Para endurecer geles de células adherente, L2 puede ser añadido al medio de cultivo de los geles porcentuales bajos para aumentar el porcentaje de reticulaciones. Para suavizar los geles de células adherente, L2 se puede quitar para disminuir el porcentaje de entrecruzamientos 10,13,21. L2 tiene una secuencia de punto de apoyo adicional en el extremo 3 'para permitir L2 para uncrosslink de SA1 y SA2 (Tabla 1). La eliminación de L2 se lleva a cabo mediante hibridación de una hebra de reversión llamado R2. R2 es complementaria a la longitud completa de L2 y se hibrida primero con el punto de apoyo L2. Hibridación propulsa el punto de apoyo de descompresión de L2 de SA1 y SA2, que elimina la reticulación y reduce la rigidez de gel.
En el presente informe yvideo, paso a paso las instrucciones se proporcionan para la preparación de rigidización y suavizar los geles de ADN. Si bien se describen preparaciones de gel 100% y 80%, este protocolo se puede adaptar para crear geles de ADN de otros porcentajes reticulados inicial y final. En general, 100% y 80% en geles se preparan, inmovilizan sobre cubreobjetos de vidrio, funcionalizados, y se sembraron con células. L2 se añade a los medios de 80% de geles y R2 se añade a los medios de comunicación de 100% geles, 48 hr después de la siembra. La adición de L2 a los medios endurece 80% a 100% geles reticulados, mientras que la adición de R2 a los medios suaviza 100% en geles de 80% reticulado. Geles endurecidas se designan como 80 → 100% geles y geles ablandados se designan como 100 → 80% de geles en el texto. Para controlar o geles estáticas, ssDNA que consiste en Ts o Como se entrega a otro conjunto de 100% y 80% en geles. Después de un mínimo de dos días siguientes modulación de elasticidad, las células pueden ser procesados y analizados.
<table border="0" cellpadding="0" cellspacing="0" fo:keep-together.within-page = "always">Cuadro 1 secuencias de base para ssDNA 9-11,13,14,18,21. Celular y estudios mecánicos han utilizados varios ddiseños de reticulación ifferent para generar geles de ADN con una gama de propiedades mecánicas estáticas y dinámicas. Los parámetros modulados en el diseño de reticulación son secuencia de bases y longitud de la secuencia o la longitud de reticulación. Negrita y cursiva ilustran base de sincronización entre SA1 y L2 y entre SA2 y L2, respectivamente.
| Diseño | ||||||||
| 1 | 2 | 3 | ||||||
| Concentración de acrilamida (%) | 10 | 10 | 10 | 4 | ||||
| SA1 SA2 más hibridado con L2 (% reticulado) | 50 | 80 | 100 | 50 | 80 | 100 | 100 | 100 |
| <strong> Elasticidad (kPa, media ± SEM) | 6,6 ± 0,6 | 17,1 ± 0,8 | 29,8 ± 2,5 | 5,85 ± 0,62 | 12.67 ± 1.33 | 22.88 ± 2.77 | 25,2 ± 0,5 | 10,4 ± 0,6 |
Tabla 2. módulo de Young (E) de geles de ADN. 9-11,13,14,18,21 concentración de acrilamida, el porcentaje de reticulación, y la longitud de reticulación puede ser modulada en geles de ADN. Diseños 1, 2 y 3 tienen 20, 28, y 40 pb longitudes de reticulación, respectivamente. 100% de geles para todos los diseños tienen módulos similares, indicando la longitud de reticulación no afecta a la elasticidad del gel. Sin embargo, las variaciones en la concentración de acrilamida alteran elasticidad del gel del ADN.
Protocol
Representative Results
Discussion
La capacidad de los geles de ADN para suavizar o endurecer antes y después de la adhesión celular las hace un modelo ideal para estudiar el papel de la rigidez del tejido dinámico en función de la célula. Todos los tres diseños se han utilizado en estudios mecánicos y biológicos. Sin embargo, los tres diseños tienen elasticidades similares en diversos porcentajes de reticulación, lo que indica la longitud de reticulación no influye elasticidad del gel de ADN (Tabla 2). En contraste, la concen…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Los autores desean agradecer a: Dr. Frank Jiang, Dr. David Lin, el Dr. Bernard Yurke y el Dr. Uday Chippada por sus contribuciones en el desarrollo de la tecnología de gel de ADN; Norell Hadzimichalis, Smit Shah, Kimberly Peterman, Robert Arter por sus comentarios y ediciones de este manuscrito; fuentes de financiación, incluida la Comisión de Nueva Jersey en la médula espinal de Investigación (Grant # 07A-019-SCR1, NAL) y Nueva Jersey Instituto de Neurociencias (MLP); y editores de Ingeniería de Tejidos, Parte A para la autorización de reimprimir las figuras 2 y 4 y Biomateriales permiso para reimprimir la figura 3.
Materials
| ssDNA | Integrated DNA Technologies (Coralville, Iowa) idtdna.com |
Do not vortex ssDNA. Gentle invert the vial and/or pipette solution to mix. | |
| PBS with calcium and magnesium | Any brand. | ||
| 100X Tris-EDTA buffer (TE buffer) | Sigma-Aldrich (St. Loius, MO) sigmaldrich.com |
T9285 | |
| 10X Tris-Borate-EDTA buffer (TBE buffer) | Sigma-Aldrich (St. Loius, MO) | 93290 | TBE is a reproductive toxin. |
| 40% Acrylamide solution | Fisher Scientific (Pittsburg, PA) | BP14021 | Acrylamide is a toxin. |
| Ammonium persulfate (APS) | Sigma-Aldrich (St. Loius, MO) | A3678 | Prepare a 2% solution in TE buffer. APS is a toxin and irratant. |
| Tetramethylethylenediamine (TEMED) | Sigma-Aldrich (St. Loius, MO) | T9281 | Prepare a 20% solution in TE buffer. TEMED is flammable, a corrosive, and a toxin. |
| 12-mm diameter round coverglass | Fisher Scientific (Pittsburg, PA) fishersci.com |
12-545-82 | |
| Norland optical adhesive 72 | Norland Products (Cranbury, NJ) norlandprod.com |
NOA72 | |
| 24-well tissue culture plate | Any brand. | ||
| Microcentrifuge tubes | Any brand. | ||
| Sulfo-SANPAH | ProteoChem or Thermo Fisher, (Rockland, IL) proteochem.com or thermofisher.com |
C111 or 22589 | Prepare a 0.315 mg/ml solution in water immediately before use. Dissolve at 37°C and filter sterilze. It is normal to observe undisolved sulfo-SANPAH in the filter. Sulfo-SANPAH is light sensitive and, therefore, the solution should be protect from light until UV exposure. |
| Poly-D-Lysine (PDL) | Sigma-Aldrich (St. Loius, MO) | P6407 | Prepare a 0.2 mg/ml solution in water and filter sterilize. |
| Collagen Type I | Affymetrix (Santa Clara, CA) affymetrix.com |
13813 | Prepare a 0.2 mg/ml solution in 0.2 N acetic acid. Solution needs to remain cold at all times to avoid polymerization. Acetic acid is a flammable, toxic, and corrosive. |
| 22 X 60 cover glass | Fisher Scientific (Pittsburg, PA) | 12-544-G | |
| Positive-displacement pipette | Gilson, Inc (Middletown, WI) gilson.com |
F148504 | |
| Heat block | Fisher Scientific (Pittsburg, PA) | 11-718 | |
| UV light source | Place gels as close as possible to the UV light. UV light can cause skin or eye injury. | ||
| Thermometer | Any brand. | ||
| Nitrogen gas | GTS-Welco (Flemington, NJ) www.praxairmidatlantic.com/ |
NI 5.0UH-R |
References
- Balaban, N. Q., et al. Force and focal adhesion assembly A close relationship studied using elastic micropatterned substrates. Nat Cell Biol. 3 (5), 466-472 (2001).
- Peppas Brannon-Peppas, L., Peppas, N. A. Dynamic and equilibrium swelling behaviour of ph-sensitive hydrogels containing 2-hydroxyethyl methacrylate. Biomaterials. 11 (9), 635-644 (1990).
- Charati, M. B., Ifkovits, J. L., Burdick, J. A., Linhardt, J. G., Kiick, K. L. Hydrophilic elastomeric biomaterials based on resilin-like polypeptides. Soft Matter. 5 (18), 3412-3416 (2009).
- Davis, K. A., Burke, K. A., Mather, P. T., Henderson, J. H. Dynamic cell behavior on shape memory polymer substrates. Biomaterials. 32 (9), 2285-2293 (2011).
- Dembo, M., Wang, Y. L. Stresses at the cell-to-substrate interface during locomotion of fibroblasts. Biophys J. 76 (4), 2307-2316 (1999).
- Gray, D. S., Tien, J., Chen, C. S. Repositioning of cells by mechanotaxis on surfaces with micropatterned youngs modulus. J Biomed Mater Res A. 66 (3), 605-614 (2003).
- Homma, M., Seida, Y., Nakano, Y. Effect of ions on the dynamic behavior of an electrodriven ionic polymer hydrogel membrane. Journal of applied Polymer Science. 82 (1), 76-80 (2001).
- Horkay, F., Tasaki, I., Basser, P. J. Osmotic swelling of polyacrylate hydrogels in physiological salt solutions. Biomacromolecules. 1 (1), 84-90 (2000).
- Jiang, F. X., Yurke, B., Firestein, B. L., Langrana, N. A. Neurite outgrowth on a DNA crosslinked hydrogel with tunable stiffnesses. Ann Biomed Eng. 36 (9), 1565-1579 (2008).
- Jiang, F. X., Yurke, B., Schloss, R. S., Firestein, B. L., Langrana, N. A. Effect of dynamic stiffness of the substrates on neurite outgrowth by using a DNA-crosslinked hydrogel. Tissue Engineering Part A. 16 (6), 1873-1889 (2010).
- Jiang, F. X., Yurke, B., Schloss, R. S., Firestein, B. L., Langrana, N. A. The relationship between fibroblast growth and the dynamic stiffnesses of a DNA crosslinked hydrogel. Biomaterials. 31 (6), 1199-1212 (2010).
- Kloxin, A. M., Tibbitt, M. W., Anseth, K. S. Synthesis of photodegradable hydrogels as dynamically tunable cell culture platforms. Nat Protoc. 5 (12), 1867-1887 (2010).
- Lin, D. C., Yurke, B., Langrana, N. A. Mechanical properties of a reversible, DNA-crosslinked polyacrylamide hydrogel. J Biomech Eng. 126 (1), 104-110 (2004).
- Lin, D. C., Yurke, B., Langrana, N. A. Use of rigid spherical inclusions in young’s moduli determination: Application to DNA-crosslinked gels. J Biomech Eng. 127 (4), 571-579 (2005).
- Luo, Y., Shoichet, M. S. Light-activated immobilization of biomolecules to agarose hydrogels for controlled cellular response. Biomacromolecules. 5 (6), 2315-2323 (2004).
- Marklein, R. A., Burdick, J. A. Spatially controlled hydrogel mechanics to modulate stem cell interactions. Soft Matter. 6 (1), 136-143 (2010).
- Pelham Jr, R. J., Wang, Y. Cell locomotion and focal adhesions are regulated by substrate flexibility. Proc Natl Acad Sci U S A. 94 (25), 13661-13665 (1997).
- Previtera, M. L., Chippada, U., Schloss, R. S., Yurke, B., Langrana, N. A. Mechanical properties of DNA-crosslinked polyacrylamide hydrogels with increasing crosslinker density. BioResearch Open Access. 1 (5), 256-259 (2012).
- Previtera, M. L., Langhammer, C. G., Firestein, B. L. Effects of substrate stiffness and cell density on primary hippocampal cultures. J Biosci Bioeng. 110 (4), 459-470 (2010).
- Previtera, M. L., Langhammer, C. G., Langrana, N. A., Firestein, B. L. Regulation of dendrite arborization by substrate stiffness is mediated by glutamate receptors. Ann Biomed Eng. 38 (12), 3733-3743 (2010).
- Previtera, M. L., Trout, K. L., Verma, D., Chippada, U., Schloss, R. S., Langrana, N. A. Fibroblast morphology on dynamic softening of hydrogels. Ann Biomed Eng. 40 (5), 1061-1072 (2012).
- Saxena, T., Gilbert, J., Stelzner, D., Hasenwinkel, J. Mechanical characterization of the injured spinal cord after lateral spinal hemisection injury in the rat. J Neurotrauma. 29 (9), 1747-1757 (2012).
- Sundararaghavan, H. G., Monteiro, G. A., Firestein, B. L., Shreiber, D. I. Neurite growth in 3d collagen gels with gradients of mechanical properties. Biotechnol Bioeng. 102 (2), 632-643 (2009).
- Wozniak, M. A., Chen, C. S. Mechanotransduction in development A growing role for contractility. Nat Rev Mol Cell Biol. 10 (1), 34-43 (2009).
- Wuerfel, J., et al. Mr-elastography reveals degradation of tissue integrity in multiple sclerosis. Neuroimage. 49 (3), 2520-2525 (2012).
- Zaari, N., Rajagopalan, P., Kim, S. K., Engler, A. J., Wong, J. Y. Photopolymerization in microfluidic gradient generators Microscale control of substrate compliance to manipulate cell response. Adv Mater. 16 (23-24), 2133-2137 (2004).

