Preparação de ADN de poliacrilamida reticulada-hidrogéis
Summary
O nosso laboratório desenvolveu hidrogéis de poliacrilamida reticulada-ADN, um sistema dinâmico de hidrogel, para compreender melhor os efeitos da modulação da rigidez do tecido sobre a função das células. Aqui, nós fornecemos esquemas, descrições e protocolos para preparar estes hidrogéis.
Abstract
Mechanobiology é uma área científica emergente que aborda o papel crítico de pistas físicas em dirigir a morfologia ea função das células. Por exemplo, o efeito da elasticidade do tecido em função celular é uma importante área de pesquisa por causa da rigidez do tecido mechanobiology modula com a doença, o desenvolvimento, e a lesão. Materiais imitando tecido-estática, ou materiais que não podem alterar a rigidez vez células são banhados, são predominantemente utilizados para investigar os efeitos da rigidez do tecido sobre as funções celulares. Embora as informações recolhidas a partir de estudos estáticos é valiosa, esses estudos não são indicativos da natureza dinâmica do microambiente celular in vivo. Para melhor enfrentar os efeitos da rigidez dinâmica em função das células, foi desenvolvido um sistema de poliacrilamida hidrogel reticulado-DNA (géis de DNA). Ao contrário de outros substratos dinâmicos, géis de DNA tem a capacidade de aumentar ou diminuir a rigidez após a fabricação, sem estímulos. Geles de ADN consistem de ADN crosslAs tintas que são polimerizados em uma espinha dorsal de poliacrilamida. Adição e remoção de ligações cruzadas através da entrega de DNA de fita simples permite temporais, espaciais e controle reversível da elasticidade gel. Temos demonstrado em relatórios anteriores que a modulação de elasticidade dinâmico gel DNA influencia o comportamento de fibroblastos e neurônio. Neste relatório e vídeo, nós fornecemos um esquema que descreve os mecanismos de reticulação do gel de DNA e instruções passo-a-passo sobre os géis de preparação de DNA.
Introduction
Substratos estáticos e dinâmicos são duas categorias de biomateriais que foram desenvolvidas para estudar os efeitos de elasticidade do tecido, ou em função da rigidez das células. Substratos estáticos são incapazes de alterar as suas propriedades físicas depois de serem fabricadas e / ou uma vez as células são banhados. Poliacrilamida (PA) foram os primeiros géis bidimensionais substratos, estáticas que foram sintetizadas para investigações mechanobiology 5,17. Geles PA são fáceis de preparar, barato, versátil e pode ser fabricado com uma ampla gama de módulos elásticos. Embora essas vantagens técnicas fazem PA géis um substrato comumente aplicado, substratos estáticas não são indicativos da natureza dinâmica da matriz extracelular (MEC) e ao ambiente circundante celular in vivo. Por exemplo, a rigidez ECM sofre alterações em resultado de ferimento, de desenvolvimento, ou doença. Substratos dinâmicos são, portanto, preferidas como substratos modelo mimetizando a tecidos em estudos mechanobiology <sup> 22,24,25.
Numerosos sintético, Bidimensional biomateriais, tridimensionais, estáticos e dinâmicos naturais têm sido desenvolvidos para imitar rigidez tecidual 1,3,6,16,23,26. Alguns substratos dinâmicas exigem calor, UV, corrente elétrica, os íons, e mudanças de pH de alterar as suas propriedades mecânicas 2,4,7,8,12,15,16, mas esses estímulos podem restringir bio-aplicação do hidrogel. Hidrogeles de poliacrilamida reticulada-DNA (DNA) são géis elásticos substratos bidimensionais dinâmicas. Ligações cruzadas de DNA permitem a modulação temporais, espaciais, e reversível da rigidez gel DNA pela adição de DNA de fita simples (ssDNA) para mídia ou buffer 9-11,13,14,18,21. Ao contrário dos géis dinâmicas acima mencionados, onde são aplicados estímulos para modulação de elasticidade, os géis de DNA contam com a difusão de ADNcs aplicada para a alteração da elasticidade. Por conseguinte, a superfície superior de gel, em que as células são cultivadas, é a primeira área modulada, porque a taxa de omodulação f elasticidade está dependente da espessura do gel.
Geles de DNA são semelhantes aos seus homólogos gel PA na medida em que têm uma espinha dorsal de poliacrilamida, no entanto, as ligações cruzadas de bis-acrilamida substituída com ligações cruzadas são compostos por ADN (Figura 1). Dois ssDNAs (SA1 e SA2) hibridar com uma cadeia reticulador (L2) para compensar as ligações cruzadas de DNA do gel. SA1 e SA2 têm seqüências distintas que ambos contêm uma modificação Acrydite no final 5 'para a incorporação efetiva na rede PA. Para a preparação do gel, SA1 e SA2 são polimerizados, individualmente, em uma espinha dorsal PA e, subsequentemente, o SA1 polimerizada e SA2 são misturados em conjunto. L2, o agente de reticulação, é adicionado à mistura de SA1 e SA2. A sequência de bases é complementar a L2 ambas as sequências SA1 e SA2 e L2 hibrida com SA1 mais SA2 para formar as ligações cruzadas de DNA. Inicial, a elasticidade de gel de ADN é determinada por ambas as concentrações de L2 e de reticulação (Tabelas 1 </strong> e 2). Geles de ADN que contenham quantidades estequiométricas iguais de L2, AE1, AE2 e os géis são mais duras, porque SA1 e SA2 são 100% reticulado por L2 (designado como 100% de gel). Baixas concentrações do resultado L2 em uma menor percentagem de reticulação DNA e, portanto, géis de DNA mais suave. Géis tão baixas como 50% reticulado (designado como 50% de gel) 9-11 foram construídas.
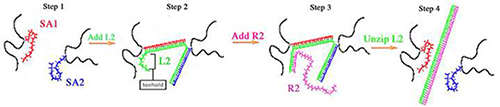
A Figura 1 de reticulação de gel do DNA e uncrosslinking esquemática 9-11,13,14,18,21 Etapa 1:. SA1 (vermelho) e SA2 (azul) são polimerizados, individualmente, em uma espinha dorsal de poliacrilamida (preto). Após a polimerização, as soluções polimerizados SA1 e SA2 são misturados em conjunto. Passo 2: L2 (verde) é adicionado e hibrida com SA1 mais SA2 para formar as ligações cruzadas do gel. Passo 3: R2 hibrida com tele toehold de L2. Passo 4: hibridização toehold de R2 impulsiona a descompactação de L2 de SA1 e SA2.
Ao contrário dos géis PA, géis de DNA pode endurecer e amaciar após a síntese. Por essa razão, as células cultivadas em géis de ADN pode ser submetido a alterações de rigidez dinâmica. Para endurecer géis de células aderentes, L2 pode ser adicionado ao meio de cultura de baixo géis percentuais, para aumentar a percentagem de ligações cruzadas. Para suavizar a géis de células aderentes, L2 podem ser removidas para reduzir a percentagem de ligações cruzadas 10,13,21. L2 tem uma sequência de ponto de apoio adicional na extremidade 3 'para permitir a L2 uncrosslink de SA1 e SA2 (Tabela 1). Remoção de L2 é realizado através de hibridação de um fio chamado inversão R2. R2 é complementar ao comprimento total de L2 e hibrida com o primeiro ponto de apoio L2. Toehold hibridação impulsiona a descompactação de L2 de SA1 e SA2, que elimina a ligação transversal e reduz a rigidez do gel.
Neste relatório evídeo, passo-a-passo as instruções são fornecidas para a preparação de endurecimento e amolecimento géis de DNA. Embora 100% e de 80% as preparações de gel são descritas, este protocolo pode ser adaptada para criar ADN de géis reticulados outras percentagens iniciais e finais. Em geral, 100% e 80% de gel são preparadas, imobilizada em lamelas de vidro, funcionalizada, e semeadas com células. L2 é adicionado à media de 80% de gel e R2 é adicionado aos meios de comunicação de 100% de gel, 48 horas após o plaqueamento. A adição de meios de L2 para endurece 80% de gel de ligação cruzada a 100%, ao passo que a adição de R2 a mídia amolece a 100% de gel de 80% de ligações cruzadas. Geles endurecidos são designados como 80 → 100% de gel e geles suavizados são designados como 100 → 80% de gel no texto. Para o controlo ou géis estáticos, ADNcs ou consistindo em Ts Como é entregue a outro conjunto de 100% e 80% de gel. Depois de um mínimo de dois dias seguintes modulação elasticidade, as células podem ser processados e analisados.
<table border="0" cellpadding="0" cellspacing="0" fo:keep-together.within-page = "always">Tabela 1. seqüências de bases para ssDNA 9-11,13,14,18,21. Celular e estudos mecânicos têm utilizado vários dmodelos de reticulação iferentes para gerar géis de ADN com uma variedade de propriedades mecânicas estáticas e dinâmicas. Os parâmetros modulados em design de reticulação são sequência de bases de comprimento e sequência ou comprimento de reticulação. Fontes em negrito e itálico ilustrar o pareamento de bases entre SA1 e L2 e entre SA2 e L2, respectivamente.
| Projeto | ||||||||
| 1 | 2 | 3 | ||||||
| Concentração de acrilamida (%) | 10 | 10 | 10 | 4 | ||||
| SA1 mais SA2 hibridado com L2 (% reticulado) | 50 | 80 | 100 | 50 | 80 | 100 | 100 | 100 |
| <strong> Elasticidade (kPa, média ± SEM) | 6,6 ± 0,6 | 17,1 ± 0,8 | 29,8 ± 2,5 | 5,85 ± 0,62 | 12,67 ± 1,33 | 22,88 ± 2,77 | 25,2 ± 0,5 | 10,4 ± 0,6 |
Tabela 2 o módulo de Young (E) de geles de ADN. 9-11,13,14,18,21 concentração de acrilamida, percentagem de ligações cruzadas, e comprimento de ligação transversal pode ser modulada em geles de ADN. Designs 1, 2 e 3 têm 20, 28 e 40 pb comprimentos de ligação transversal, respectivamente. 100% de gel para todos os projetos têm módulos semelhantes indicando comprimento reticulação não afeta a elasticidade gel. No entanto, as variações na concentração de acrilamida alterar a elasticidade em gel de ADN.
Protocol
Representative Results
Discussion
A capacidade dos geles de ADN para amolecer ou endurecer antes e após a adesão das células torna-os um modelo ideal para estudar o papel da rigidez do tecido dinâmico em função da célula. Todos os três modelos têm sido utilizados em estudos biológicos e mecânicos. No entanto, todos os três modelos têm elasticidade semelhantes em várias percentagens de reticulação, que indica o comprimento de reticulação não influenciar a elasticidade de gel do DNA (Tabela 2). Em contraste, a concentra…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Os autores gostariam de agradecer: Dr. Frank Jiang, Dr. David Lin, Dr. Bernard Yurke e Dr. Uday Chippada por suas contribuições sobre o desenvolvimento da tecnologia do gel de DNA; Dr. Norell Hadzimichalis, Smit Shah, Kimberly Peterman, Robert Arter pelos seus comentários e edições deste manuscrito; fontes de financiamento, incluindo a Comissão Jersey New on Spinal Cord Research (Grant # 07A-019-SCR1, NAL) e New Jersey Institute Neuroscience (MLP); e editores de Engenharia de Tecidos, Parte A permissão para reimprimir Figuras 2 e 4 e Biomateriais permissão para reimprimir figura 3.
Materials
| ssDNA | Integrated DNA Technologies (Coralville, Iowa) idtdna.com |
Do not vortex ssDNA. Gentle invert the vial and/or pipette solution to mix. | |
| PBS with calcium and magnesium | Any brand. | ||
| 100X Tris-EDTA buffer (TE buffer) | Sigma-Aldrich (St. Loius, MO) sigmaldrich.com |
T9285 | |
| 10X Tris-Borate-EDTA buffer (TBE buffer) | Sigma-Aldrich (St. Loius, MO) | 93290 | TBE is a reproductive toxin. |
| 40% Acrylamide solution | Fisher Scientific (Pittsburg, PA) | BP14021 | Acrylamide is a toxin. |
| Ammonium persulfate (APS) | Sigma-Aldrich (St. Loius, MO) | A3678 | Prepare a 2% solution in TE buffer. APS is a toxin and irratant. |
| Tetramethylethylenediamine (TEMED) | Sigma-Aldrich (St. Loius, MO) | T9281 | Prepare a 20% solution in TE buffer. TEMED is flammable, a corrosive, and a toxin. |
| 12-mm diameter round coverglass | Fisher Scientific (Pittsburg, PA) fishersci.com |
12-545-82 | |
| Norland optical adhesive 72 | Norland Products (Cranbury, NJ) norlandprod.com |
NOA72 | |
| 24-well tissue culture plate | Any brand. | ||
| Microcentrifuge tubes | Any brand. | ||
| Sulfo-SANPAH | ProteoChem or Thermo Fisher, (Rockland, IL) proteochem.com or thermofisher.com |
C111 or 22589 | Prepare a 0.315 mg/ml solution in water immediately before use. Dissolve at 37°C and filter sterilze. It is normal to observe undisolved sulfo-SANPAH in the filter. Sulfo-SANPAH is light sensitive and, therefore, the solution should be protect from light until UV exposure. |
| Poly-D-Lysine (PDL) | Sigma-Aldrich (St. Loius, MO) | P6407 | Prepare a 0.2 mg/ml solution in water and filter sterilize. |
| Collagen Type I | Affymetrix (Santa Clara, CA) affymetrix.com |
13813 | Prepare a 0.2 mg/ml solution in 0.2 N acetic acid. Solution needs to remain cold at all times to avoid polymerization. Acetic acid is a flammable, toxic, and corrosive. |
| 22 X 60 cover glass | Fisher Scientific (Pittsburg, PA) | 12-544-G | |
| Positive-displacement pipette | Gilson, Inc (Middletown, WI) gilson.com |
F148504 | |
| Heat block | Fisher Scientific (Pittsburg, PA) | 11-718 | |
| UV light source | Place gels as close as possible to the UV light. UV light can cause skin or eye injury. | ||
| Thermometer | Any brand. | ||
| Nitrogen gas | GTS-Welco (Flemington, NJ) www.praxairmidatlantic.com/ |
NI 5.0UH-R |
References
- Balaban, N. Q., et al. Force and focal adhesion assembly A close relationship studied using elastic micropatterned substrates. Nat Cell Biol. 3 (5), 466-472 (2001).
- Peppas Brannon-Peppas, L., Peppas, N. A. Dynamic and equilibrium swelling behaviour of ph-sensitive hydrogels containing 2-hydroxyethyl methacrylate. Biomaterials. 11 (9), 635-644 (1990).
- Charati, M. B., Ifkovits, J. L., Burdick, J. A., Linhardt, J. G., Kiick, K. L. Hydrophilic elastomeric biomaterials based on resilin-like polypeptides. Soft Matter. 5 (18), 3412-3416 (2009).
- Davis, K. A., Burke, K. A., Mather, P. T., Henderson, J. H. Dynamic cell behavior on shape memory polymer substrates. Biomaterials. 32 (9), 2285-2293 (2011).
- Dembo, M., Wang, Y. L. Stresses at the cell-to-substrate interface during locomotion of fibroblasts. Biophys J. 76 (4), 2307-2316 (1999).
- Gray, D. S., Tien, J., Chen, C. S. Repositioning of cells by mechanotaxis on surfaces with micropatterned youngs modulus. J Biomed Mater Res A. 66 (3), 605-614 (2003).
- Homma, M., Seida, Y., Nakano, Y. Effect of ions on the dynamic behavior of an electrodriven ionic polymer hydrogel membrane. Journal of applied Polymer Science. 82 (1), 76-80 (2001).
- Horkay, F., Tasaki, I., Basser, P. J. Osmotic swelling of polyacrylate hydrogels in physiological salt solutions. Biomacromolecules. 1 (1), 84-90 (2000).
- Jiang, F. X., Yurke, B., Firestein, B. L., Langrana, N. A. Neurite outgrowth on a DNA crosslinked hydrogel with tunable stiffnesses. Ann Biomed Eng. 36 (9), 1565-1579 (2008).
- Jiang, F. X., Yurke, B., Schloss, R. S., Firestein, B. L., Langrana, N. A. Effect of dynamic stiffness of the substrates on neurite outgrowth by using a DNA-crosslinked hydrogel. Tissue Engineering Part A. 16 (6), 1873-1889 (2010).
- Jiang, F. X., Yurke, B., Schloss, R. S., Firestein, B. L., Langrana, N. A. The relationship between fibroblast growth and the dynamic stiffnesses of a DNA crosslinked hydrogel. Biomaterials. 31 (6), 1199-1212 (2010).
- Kloxin, A. M., Tibbitt, M. W., Anseth, K. S. Synthesis of photodegradable hydrogels as dynamically tunable cell culture platforms. Nat Protoc. 5 (12), 1867-1887 (2010).
- Lin, D. C., Yurke, B., Langrana, N. A. Mechanical properties of a reversible, DNA-crosslinked polyacrylamide hydrogel. J Biomech Eng. 126 (1), 104-110 (2004).
- Lin, D. C., Yurke, B., Langrana, N. A. Use of rigid spherical inclusions in young’s moduli determination: Application to DNA-crosslinked gels. J Biomech Eng. 127 (4), 571-579 (2005).
- Luo, Y., Shoichet, M. S. Light-activated immobilization of biomolecules to agarose hydrogels for controlled cellular response. Biomacromolecules. 5 (6), 2315-2323 (2004).
- Marklein, R. A., Burdick, J. A. Spatially controlled hydrogel mechanics to modulate stem cell interactions. Soft Matter. 6 (1), 136-143 (2010).
- Pelham Jr, R. J., Wang, Y. Cell locomotion and focal adhesions are regulated by substrate flexibility. Proc Natl Acad Sci U S A. 94 (25), 13661-13665 (1997).
- Previtera, M. L., Chippada, U., Schloss, R. S., Yurke, B., Langrana, N. A. Mechanical properties of DNA-crosslinked polyacrylamide hydrogels with increasing crosslinker density. BioResearch Open Access. 1 (5), 256-259 (2012).
- Previtera, M. L., Langhammer, C. G., Firestein, B. L. Effects of substrate stiffness and cell density on primary hippocampal cultures. J Biosci Bioeng. 110 (4), 459-470 (2010).
- Previtera, M. L., Langhammer, C. G., Langrana, N. A., Firestein, B. L. Regulation of dendrite arborization by substrate stiffness is mediated by glutamate receptors. Ann Biomed Eng. 38 (12), 3733-3743 (2010).
- Previtera, M. L., Trout, K. L., Verma, D., Chippada, U., Schloss, R. S., Langrana, N. A. Fibroblast morphology on dynamic softening of hydrogels. Ann Biomed Eng. 40 (5), 1061-1072 (2012).
- Saxena, T., Gilbert, J., Stelzner, D., Hasenwinkel, J. Mechanical characterization of the injured spinal cord after lateral spinal hemisection injury in the rat. J Neurotrauma. 29 (9), 1747-1757 (2012).
- Sundararaghavan, H. G., Monteiro, G. A., Firestein, B. L., Shreiber, D. I. Neurite growth in 3d collagen gels with gradients of mechanical properties. Biotechnol Bioeng. 102 (2), 632-643 (2009).
- Wozniak, M. A., Chen, C. S. Mechanotransduction in development A growing role for contractility. Nat Rev Mol Cell Biol. 10 (1), 34-43 (2009).
- Wuerfel, J., et al. Mr-elastography reveals degradation of tissue integrity in multiple sclerosis. Neuroimage. 49 (3), 2520-2525 (2012).
- Zaari, N., Rajagopalan, P., Kim, S. K., Engler, A. J., Wong, J. Y. Photopolymerization in microfluidic gradient generators Microscale control of substrate compliance to manipulate cell response. Adv Mater. 16 (23-24), 2133-2137 (2004).

